
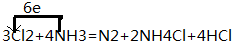
分析 (1)氧化还原中,得、失电子总数相等,进行配平,并用单线桥或者双线桥表示电子转移的方向和数目;
(2)根据化合价的升降判断还原剂和还原产物;
(3)生成的气体为氮气和氯化氢,二者物质的量之比为:1:4,可计算出氮气物质的量,氨气中的N元素被氧化为氮气,据此计算.
解答 解:(1)氯气具有强氧化性,氨气具有还原性,故氯气被还原为-1价,氨气中的N元素被氧化为0价,则可写出生成物为:N2、NH4Cl和HCl,由于已知:3Cl2+4NH3,观察法配平,得到:3Cl2+4NH3=N2+2NH4Cl+4HCl;氨气N元素失去6e-,氯气中Cl得到6e-,用单线桥表示电子转移方向和数目为: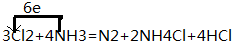 ,故答案为:
,故答案为: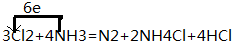 ;
;
(2)还原剂为化合价升高的反应物,氨气中N元素化合价升高,则氨气为还原剂;发生还原反应得到的产物为还原产物,即化合价降低的生成物,可知NH4Cl 和HCl中Cl元素化合价降低的元素,故还原产物为:NH4Cl 和HCl,故答案为:NH3;NH4Cl 和HCl;
(3)生成的气体为氮气和氯化氢,物质的量n=$\frac{4.48L}{22.4L/mol}$=0.2mol,根据反应③可知,氮气与氯化氢体积比为1:4,即n(N2)=0.2mol×$\frac{1}{5}$=0.04mol,根据2NH3→N2,即被氧化气体的物质的量为氮气物质的量的2倍,故被氧化气体物质的量为0.04mol×2=0.08mol,
故答案为:0.08.
点评 本题考查了查氧化还原反应,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,解答本题注意从质量守恒的角度判断生成物,题目难度中等.


科目:高中化学 来源: 题型:选择题
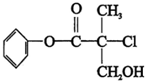
| A. | 有机物A 属于芳香烃 | |
| B. | 有机物A 可以与Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A 与浓硫酸混合加热,可以发生消去反应 | |
| D. | 有机物A 可与NaOH 溶液反应,生成多种可溶于水的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①②③④ | C. | ②③ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 侯德榜提出的联合制碱法可大大提高氯化钠的利用率 | |
| B. | 具有永久硬度的硬水可以采用加热的方法进行软化 | |
| C. | CO.CH4、CH3OH是一碳化学的主要原料 | |
| D. | 复合材料一般由起黏结作用的基体和起增强作用的增强体构成 | |
| E. | 油脂和氢氧化钠共热产生的混合物,加入食盐可使肥皂析出. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和CO2都是酸性氧化物,SO2与Na2O2反应生成Na2SO3和O2 | |
| B. | 84 g NaHCO3受热分解,将生成的气体通过足量的Na2O2,固体质量增加31 g | |
| C. | 将Na2O2投入到酚酞试液中,溶液变红 | |
| D. | Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液由黄色变为浅绿色 | B. | 溶液由浅绿色变为黄色 | ||
| C. | 溶液由浅绿色变为血红色 | D. | 有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中不一定含有Na+ | |
| B. | 该溶液中肯定含有NH4+、SO42-、CO32-、NO3- | |
| C. | 该溶液中一定不含NO3- | |
| D. | 该溶液中一定含Na+,且c(Na+)≥0.1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com