
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中c(H +)=$\sqrt{{K}_{W}}$mol/L | |
| C. | pH均为11的NaOH和Na2CO3溶液中,水的电离程度相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
分析 A.醋酸是弱电解质,稀释后c(H+)减小,但是c(OH-)增大;
B.KW=c(H+)•c(OH-),中性时c(H+)=c(OH-),据此进行计算;
C.氢氧化钠抑制了水的电离,碳酸钠溶液促进了水的电离;
D.硫酸是强电解质,溶液中完全电离,醋酸是弱电解质,部分电离.
解答 解:A.稀释pH=3的醋酸溶液,稀释后c(H+)减小,由于水的离子积不变,c(OH-)增大,故A错误;
B.KW=c(H+)•c(OH-),中性时c(H+)=c(OH-),则c(H+)=$\sqrt{{K}_{W}}$mol/L,故B正确;
C.氢氧化钠为强碱,电离出的氢氧根离子抑制了水的电离,而碳酸钠为强碱弱酸盐,碳酸根离子部分水解,促进了水的电离,所以水的电离程度不同,故C错误;
D、c(H+)=10-PH,硫酸是强电解质,氢离子完全电离出来;醋酸是弱电解质,氢离子部分电离,c(醋酸)>c(H+),所以醋酸消耗的氢氧化钠比硫酸多,故D错误;
故选B.
点评 本题考查了弱电解质电离及其影响,题目难度中等,明确弱电解质的电离平衡特点及其影响为解答关键,注意掌握盐的水解原理及其应用方法.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取二氧化氮时,用水或NaOH溶液吸收尾气 | |
| B. | 用将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红的方法来检验Fe(NO3)2晶体是否变质 | |
| C. | 锥形瓶可用作加热的反应器 | |
| D. | 只滴加氨水可以鉴别出NaCl、AlCl3、Na2SO4、MgCl2四种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常用电解熔融D的氧化物来制备D的单质 | |
| B. | 单质C、D着火,灭火时C不能用泡沫灭火器,但D可以用泡沫灭火器灭火 | |
| C. | 化合物A2B2与C2B2所含化学键类型完全相同 | |
| D. | A、B、C组成的化合物,若溶液浓度为0.01mol/L,则由水电离出的OH-为10-12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
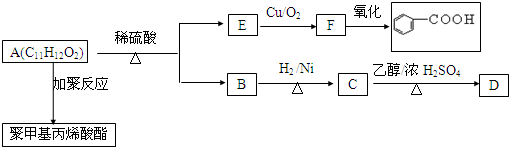
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于海水的净化,但不能用于海水的淡化 | |
| B. | 使用清洁能源是防止酸雨的重要的措施 | |
| C. | 胃酸过多的病人均可服用含Al(OH)3或NaHCO3的药物进行治疗 | |
| D. | 84消毒液可用来漂白某些衣物,为加快漂白速度,使用时可加入少量稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D、E以原子个数比2:1形成的化合物,只含离子键 | |
| B. | 元素A、B、C的单质晶体可能属于同种类型的晶体,也可能是不同类型的晶体.如果B在A2B7CD分子中有四种不同的环境,则该分子不能与硫酸反应 | |
| C. | 含E的某种离子的水溶液,滴加某种含A、C或A、C、D元素组成的离子的溶液,均可生成配合物 | |
| D. | B与C形成的化合物其沸点一定高于A与B形成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| B. | 用氢氧化铁胶体进行电泳实验时,阴极区域颜色加深,说明氢氧化铁胶体带正电荷 | |
| C. | 含Fe元素的质量分数为70%的铁红一定是纯净物 | |
| D. | 在干冰晶体中,每个CO2分子周围与之最接近而且距离相等的CO2分子有6个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com