
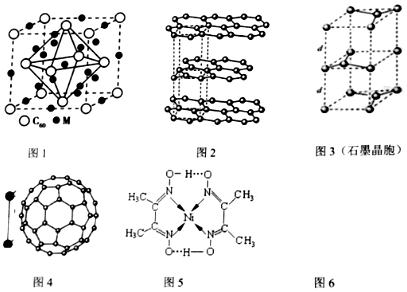
分析 (1)Ni元素是28号元素,根据核外电子排布规律书写基态原子的电子排布式和价层电子排布式,根据镍配合物结构图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键;
(2)根据均摊法计算晶胞中M原子数目、C60个数,进而确定化学式;
(3)石墨烯中碳原子周围有三个共价键,据此判断碳原子的杂化方式;晶胞中顶点占$\frac{1}{8}$,棱上占$\frac{1}{4}$,面上占$\frac{1}{2}$,中心为1,据此计算石墨晶胞含碳原子个数;
(4)利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中π键的数目;C60采用面心立方最密堆积;C60分子其固体属于分子晶体;C60与二氧化硫都是非极性分子,相似相溶,而水是极性分子;晶胞中C60分子间的最短距离为d cm,则棱长为2d×$\frac{\sqrt{2}}{2}$cm=$\sqrt{2}$dcm,晶胞的体积=2$\sqrt{2}$d3cm3,该晶胞中C60分子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,再结合ρV=m计算.
解答 解:(1)Ni元素是28号元素,位于第四周期第Ⅷ族,其基态原子的电子排布式1s22s22p63s23p63d84s2,则价电子排布式为3d84s2,根据镍配合物结构图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键,
故答案为:3d84s2;ACE;
(2)晶胞中,M原子个数=8+12×$\frac{1}{4}$+1=12、C60个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则C60与M原子个数之比=4:12=1:3,其化学式为:M3C60,
故答案为:M3C60;
(3)石墨烯中碳原子周围有三个共价键,碳原子的杂化方式为sp2,晶胞中C原子数目为1+2×$\frac{1}{2}$+8×$\frac{1}{8}$+4×$\frac{1}{4}$=4,
故答案为:sp2;4;
(4)每个碳原子含有的π键个数为$\frac{1}{2}$,所以1molC60分子中π键的数目为$\frac{1}{2}$×60×NA=30NA;C60分子其固体属于分子晶体,C60采用面心立方最密堆积,其配位数为12;非极性分子的溶质易溶于非极性分子的溶剂,C60、CS2都是非极性分子,C60能溶于二硫化碳中形成无色透明的溶液,水是极性分子,不溶于水,晶胞中C60分子间的最短距离为d cm,则棱长为2d×$\frac{\sqrt{2}}{2}$cm=$\sqrt{2}$dcm,晶胞的体积=2$\sqrt{2}$d3cm3,该晶胞中C60分子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,ρ=$\frac{m}{V}$=$\frac{4×720}{2\sqrt{2}{d}^{3}×{N}_{A}}$,解得d=$\frac{1}{\sqrt{2}}\root{3}{\frac{2880}{ρ×{N}_{A}}}×1{0}^{7}$nm.
故答案为:30NA;12;分子;C60与二氧化硫都是非极性分子,相似相溶,而水是极性分子;$\frac{1}{\sqrt{2}}\root{3}{\frac{2880}{ρ×{N}_{A}}}×1{0}^{7}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键、晶胞结构与计算、杂化轨道,晶胞结构对学生的空间想象有一定的要求,注意利用均摊法进行计算,题目难度中等.


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①和③ | C. | ①②③⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚中加入Na2CO3溶液中:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 0.3molFeI2与0.4molCl2在溶液中反应:6Fe2++10I-+8Cl2═6Fe3++16Cl-+5I2 | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应后溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
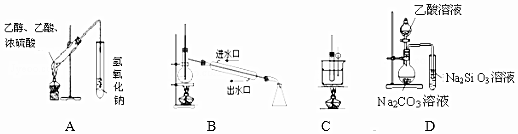
| A. | 装置用于制备乙酸乙酯 | |
| B. | 装置用于石油的分馏 | |
| C. | 装置用于实验室制硝基苯 | |
| D. | 装置可装置证明酸性:乙酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为 8、中子数为 10 的氧原子:${\;}_{8}^{10}$O | |
| B. | 过氧化钠的电子式: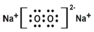 | |
| C. | 氧原子的电子排布图:1s22s22p4 | |
| D. | 次氯酸的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断裂1 mol H2O中的化学键需要吸收925.6 KJ的能量 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4 KJ•mol-1 | |
| C. | 2H2O(l)═2H2(g)+O2(g)△H=471.6 KJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝和铁是日常生活中用途广泛的金属.
铝和铁是日常生活中用途广泛的金属.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com