
【题目】A、B、C、D、E五种物分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①0.001 mol/L的A溶液pH=3;
②B溶液和D溶液显碱性,等浓度两者PH关系B< D;
③E是弱电解质。回答下列问题:
(1)D是____________溶液,判断理由是______________________。
(2)用水稀释0.1 mol·L-1 B时,溶液中随着水量的增加而减小的是________(填写序号)。
①![]() ②
②![]() ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
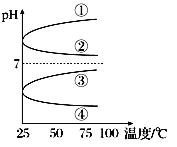
(3)将等体积、等物质的量浓度B和C的溶液混合,升高温度(溶质不会分解)溶液pH随温度变化为图中的________曲线(填写序号)。
(4)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌的物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌剩余 ⑥E溶液里有锌剩余
【答案】(1)NaOH;一水合氨是一元弱碱,氢氧化钠是一元强碱,B溶液和D溶液显碱性,等浓度两者pH关系B<D,因此D是氢氧化钠 (2)①② (3)④ (4)③④⑤
【解析】
试题分析:(1)五种物质中NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种,CH3COOH、HCl、NH4HSO4均显酸性,NaOH、NH3·H2O显碱性,0.001 mol/L的A溶液pH=3,则A是盐酸;B溶液和D溶液显碱性,等浓度两者pH关系B<D,所以B是NH3·H2O,D是氢氧化钠。E是弱电解质,所以E是醋酸,则C是NH4HSO4。
(2)①由NH3·H2O![]() OH- +NH4 + 可知,加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,则c(NH3H2O)/c(OH)=n(NH3H2O)/n(OH)减小,正确;②由NH3·H2O
OH- +NH4 + 可知,加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,则c(NH3H2O)/c(OH)=n(NH3H2O)/n(OH)减小,正确;②由NH3·H2O![]() OH- +NH4 + 可知加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,c(NH3·H2O)、c(OH-)都减小,c(H+ )增大,则c(OH)÷c(H+)减小,正确;③因加水稀释时,温度不变,则Kw=c(H+ )·c(OH)是个常数,错误;④由NH3·H2O
OH- +NH4 + 可知加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,c(NH3·H2O)、c(OH-)都减小,c(H+ )增大,则c(OH)÷c(H+)减小,正确;③因加水稀释时,温度不变,则Kw=c(H+ )·c(OH)是个常数,错误;④由NH3·H2O![]() OH- +NH4 + 可知,加水促进电离,OH-的物质的量增大,错误,答案选①②;
OH- +NH4 + 可知,加水促进电离,OH-的物质的量增大,错误,答案选①②;
(3)NH3·H2O是碱,pH>7,NH4 HSO4电离产生H+,使溶液显酸性,pH<7,等体积、等物质的量浓度NH3·H2O和与NH4 HSO4 混合后溶液发生反应:NH3·H2O+ NH4 HSO4 =(NH4 )2 SO4 +H2 O,(NH4 )2 SO4是强酸弱碱盐,NH4+会要发生水解:NH4 +H2O![]() NH3·H2O+H+ ,溶液呈酸性,加热水解平衡正向移动,c(H+)增大,pH减小,④符合题意;
NH3·H2O+H+ ,溶液呈酸性,加热水解平衡正向移动,c(H+)增大,pH减小,④符合题意;
(4)①A是HCl,E是CH3COOH,若二者的OH-相等,则溶液中H+的浓度也相等,由于醋酸是弱酸,溶液中存在电离平衡,电离产生的离子浓度远小于酸分子的浓度,所以c(CH3COOH)>c(HCl),根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,错误;②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,错误;③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,正确;④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,正确;⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,正确;⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,错误。故说法正确的是③④⑤。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,错误的是

A.装置①可用于电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等气体
C.装置③可用于检查乙炔的还原性
D.装置④可用于干燥、收集氨气、并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下现象与电化腐蚀无关的是( )
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B. 生铁比软铁芯(几乎是纯铁)容易生锈
C. 铁质器件附有铜质配件,在接触处易生铁锈
D. 银制奖牌久置后表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:

下列说法不正确的是( )
A.该过程中CeO2为H2O、CO2转变为H2、CO的催化剂
B.该过程实现了太阳能向化学能的转化
C.1molCeO2参加反应,共生成2x mol的气体
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
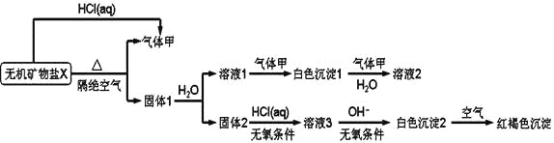
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,
写出气体甲的电子式________。
(2)X的化学式是____,在惰性气流中加热X至完全分解的化学方程式为_______________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是________________。
(用化学方程式表示)。
(4)一定条件下,气体甲与固体1中某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式____________________,并设计实验方案验证该反应的产物_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下H2的密度是0.893gL-1。某烧杯中加入50.0mL水,并放入一小块金属钠,反应完全后冷却称量所得溶液,其质量为52.2g。试求:
(1)加入的钠的质量;
(2)所得H2在常温下的体积;
(3)所得溶液中NaOH的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
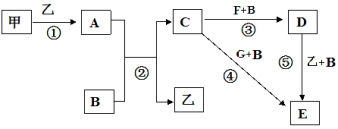
请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。
(2)反应⑤的化学方程式为____________________________。
(3)甲与B反应的离子方程式 ______________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是_____________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com