
�״�����Ҫ����ɫ��Դ֮һ��Ŀǰ��ѧ����ˮú��(CO+H2)�ϳɼ״����䷴ӦΪ��
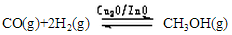 ��H=-128.1kJ��mol-1���ش��������⣺
��H=-128.1kJ��mol-1���ش��������⣺
��1���÷�Ӧ�ǿ��淴Ӧ��Ϊʹ��ѧ��Ӧ���ʺ�CO��ת���ʶ�ͬʱ��ߵĴ�ʩ��_____________��д��������
��2�����º���������˵���ÿ��淴Ӧ��ƽ�����______________��
A��2v����H2����v�棨CH3OH��
B��n��CO����n��H2����n��CH3OH����1:2:1
C�����������ܶȲ���
D����������ƽ����Է�����������
��3�����������淴Ӧ�ں��º��ݵ��ܱ��������У���ʼʱ����������г���1molCO(g)��2molH2(g)��ʵ����H2��ƽ��ת�������¶�(T)��ѹǿ(P)�ı仯��ͼ��ʾ��

�÷�Ӧ�ġ�S____________0��ͼ�е�T1___________T2�������������������
��T1�µ���ƽ��״̬Aʱ�����������Ϊ2L����ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ_____________�����ﵽƽ��״̬Bʱ�������������V(B)��________L��
��4����֪��H2(g)ȼ���ȡ�H=-285.8kJ��mol-1����CO(g)ȼ���ȡ�H=-283.0kJ��mol-1����CH3OH(g)ȼ���ȵ��Ȼ�ѧ����ʽ��Ϊ____________��
 ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д� ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ��У��һ�����л�ѧ���������棩 ���ͣ�ѡ����
��֪����Ǧ������ˮ��Ҳ���������ᣬȴ�����ڴ������Һ�У��γ���ɫ����Һ���仯ѧ����ʽ�ǣ�PbSO4+2NH4Ac  Pb(Ac)2+(NH4)2SO4����Pb(Ac)2(����Ǧ)��Һ��ͨ��H2Sʱ���к�ɫ����PbS���������HAc���ɡ���ʾ�����Ӧ���й����ӷ���ʽ��ȷ����( )
Pb(Ac)2+(NH4)2SO4����Pb(Ac)2(����Ǧ)��Һ��ͨ��H2Sʱ���к�ɫ����PbS���������HAc���ɡ���ʾ�����Ӧ���й����ӷ���ʽ��ȷ����( )
A��Pb(Ac)2+H2S PbS��+2HAc
PbS��+2HAc
B��Pb2++H2S PbS��+2H+
PbS��+2H+
C��Pb2++2Ac-+H2S PbS��+2HAc
PbS��+2HAc
D��Pb2++2Ac-+2H++S2�� PbS��+2HAc
PbS��+2HAc
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ��У�߶������л�ѧ���������棩 ���ͣ�ѡ����
���и������������Ը��������Һ����ˮ�����������( )
A�����ͼױ� B��1����ϩ�Ͷ��ױ� C������1����ϩ D������ͱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�������ѧ��һ12���¿��Ļ�ѧ���������棩 ���ͣ�ѡ����
��ȥNa2CO3 ����������NaHCO3����ѷ����ǣ� ��
A�������������� B������NaOH��Һ C������ D�������Һ��ͨ��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�������ѧ��һ12���¿��Ļ�ѧ���������棩 ���ͣ�ѡ����
�����йؽ���Ԫ�����ʵ���������ȷ���ǣ� ��
A������Ԫ�ص�ԭ��ֻ�л�ԭ�ԣ�����ֻ��������
B������Ԫ���ڻ�������һ���������ϼ�
C������Ԫ������Ȼ����ȫ���Ի���̬����
D������Ԫ�صĵ����ڳ����¾�Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�Ĵ�ʡ�Թ��и�����һ����Ͽ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͼװ����ȡ���ᴿ���ռ��±��е��������壨a��b��c��d��ʾ��Ӧ�����м�����Լ����ռ�װ����ȥ�������п��е���
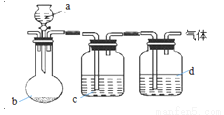
���� | a | b | c | d | |
A |
| ϡ���� | ʯ��ʯ | ���� | Ũ |
B |
| Ũ���� |
| ���� | Ũ |
C |
| ���� | ��ʯ�� |
| ��ʯ�� |
D |
| ���� | � |
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ�����и���12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��t��ʱ��Ag2CrO4(�ٺ�ɫ)��ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ����֪AgCl��Ksp��1.8��10��10������˵������ȷ���ǣ� ��
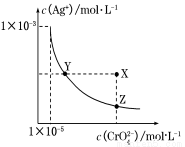
A��t��ʱ��Ag2CrO4��KspΪ1��10��8
B������Ag2CrO4��Һ�м���K2CrO4����ʹ��Һ��Y���ΪX��
C��t��ʱ��Y���Z��ʱAg2CrO4��Ksp���
D��t��ʱ����0.01 mol��L��1AgNO3��Һ����20 mL 0.01 mol��L��1KCl��0.01 mol��L��1K2CrO4�Ļ����Һ�У�Cl���ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ����У����������һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ���ǣ� ��
A����֪���볣��H2SO3��K1=1.3��10-2��K2=6.3��10-8��H2CO3��K1=4.2��10-7��K2=5.6��10-11��
H2SO3��Һ��NaHCO3��Һ��Ӧ��H2SO3+2HCO3-=SO32-+2CO2��+2H2O
B������pHΪ9~10����NaClO��Һ����NaCN�ķ�ˮ�е�CN-����Ϊ��������Ⱦ�����壺
2CN-+5ClO-+2H+=N2��+2CO2��+5Cl-+H2O
C����֪����Ǧ������ˮ��Ҳ���������ᣬȴ�����ڴ������Һ�У��γ���ɫ��Һ����Pb(CH3COO)2��Һ��ͨ��H2S����ʱ�к� ɫ�������ɣ�Pb2++H2S=PbS��+2H+
ɫ�������ɣ�Pb2++H2S=PbS��+2H+
D��CuSO4��Һ�����Ũ��ˮ��Ӧ��Cu2++4NH3��H2O=[Cu(NH3)4]2++4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��һ���¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
��������������
A��0.1mol/L��ˮ�У�c(OH��)��c(NH4+)+ c(H+)
B��10mL0.02mol/LHCl��Һ��10mL0.02mol/LBa(OH)2��Һ��ֻ�ϣ�����Ϻ���Һ�����Ϊ20mL������Һ��pH��12
C����0.1mol/LCH3COONa��Һ�У�c(OH-)��c(CH3COOH)��c(H��)
D��0.1mol/Lij��Ԫ����ǿ����NaHA��Һ�У�c(Na+)=c(A2-)+c(HA-)+c(H2A)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com