
【题目】氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应式为____________________,负极反应式为___________________;若在常温下转移2mol电子,可产生水质量为_________g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到1.12L(标准状况)气体。此时氢氧燃料电池中消耗H2的质量是_______,混合溶液中NaOH的物质的量浓度是__________mol·L-1。
(3)已知可逆反应:AsO43-+2I-+2H+![]() AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
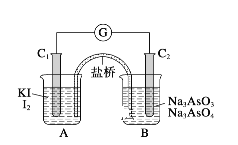
(Ⅰ)若向B中逐滴加入浓盐酸,上述反应向右进行,发现检流计指针向左偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现检流计指针与(Ⅰ)中偏转方向相反。
试回答问题:
操作(Ⅰ)中,C1棒上的反应式为_____________________________。
操作(Ⅱ)中,C2棒上的反应式为______________________________。
【答案】O2 + 4e- + 4H+ = 2H2O 2H2 - 4e- = 4 H+ 18 0.3g 1 C1棒 2I- - 2e- = I2 C2棒 AsO33- - 2e- + 2OH- = AsO43-+H2O
【解析】
(1)H2、O2燃料电池,电解质溶液为硫酸,正极氧气得电子与氢离子反应生成水,负极氢气失电子生成氢离子;
(2)阴极:Cu2++2e- =Cu,2H2O+ 2e-=2OH- +H2![]() ,阳极:2Cl- - 2e- = Cl2
,阳极:2Cl- - 2e- = Cl2![]() ;
;
(3)用平衡理论判断AsO43-+2I-+2H+![]() AsO33-+I2+H2O移动方向。
AsO33-+I2+H2O移动方向。
(1)H2、O2燃料电池,电解质溶液为硫酸,正极氧气得电子与氢离子反应生成水,负极氢气失电子生成氢离子,电极反应式分别为O2 + 4e- + 4H+ = 2H2O、2H2 - 4e- = 4H+;常温下转移2mol电子,可生成1mol水,即18g;
(2)电解由NaCl和CuSO4组成的混合溶液,阴极:Cu2++2e- =Cu,2H2O+ 2e-=2OH- +H2![]() ,c(Cu2+)=1mol/L,溶液为100mL,需要0.2mol电子;生成标准状况1.12L氢气,需要0.1mol电子,合计0.3mol,则电池的负极消耗0.15mol氢气,即0.3g;阳极:2Cl- - 2e- = Cl2
,c(Cu2+)=1mol/L,溶液为100mL,需要0.2mol电子;生成标准状况1.12L氢气,需要0.1mol电子,合计0.3mol,则电池的负极消耗0.15mol氢气,即0.3g;阳极:2Cl- - 2e- = Cl2![]() ,n(Cl-)=0.3mol,则阳极生成n(OH-)=0.1mol,则c(NaOH)=1mol/L;
,n(Cl-)=0.3mol,则阳极生成n(OH-)=0.1mol,则c(NaOH)=1mol/L;
(3)向B中逐滴加入浓盐酸,溶液中氢离子浓度增大,平衡正向进行AsO43-+2e-+2H+![]() AsO33-+H2O,则C1棒上的反应式为2I- - 2e- = I2;
AsO33-+H2O,则C1棒上的反应式为2I- - 2e- = I2;
向B中滴加40%的NaOH溶液,平衡逆向移动,C2棒发生AsO33-+2OH- -2e-![]() AsO43-+H2O。
AsO43-+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】漳州市海水资源丰富,漳浦盐场是福建省第三大国有盐场,盐田面积达700万平方米,每年产盐5万多吨。海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。

回答下列问题:
⑴NaClO3中氯的化合价_____________。
⑵在a、b、c、d提取镁的过程中,没有涉及的化学反应类型是_________(填序号)。
①分解反应 ②化合反应 ③复分解反应 ④置换反应
⑶苦卤中通入氯气发生的主要离子反应方程式为___________________________________。⑷步骤a中的沉淀剂是____________________。
⑸步骤d中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是____________(填序号)。
①N2 ②H2 ③CO2 ④空气
⑹假设该海域海水中MgCl2浓度9.5×10-3g·L-1 ,欲获得24g金属镁需要________L海水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硅酸盐可以改写成氧化物的形式,将下列硅酸盐改写成氧化物的形式:
①镁橄榄石(Mg2SiO4):____。
②高岭石[Al2(Si2O5)(OH)4]:____。
(2)写出下列反应的方程式:
①漂白粉露置于空气中较长时间后失效的化学方程式: _________________________。
②Cl2通入NaOH溶液中,发生反应的离子方程式:________________________。
③NO2与水反应的化学方程式为___________,该反应中氧化剂与还原剂的物质的量之比为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.标准状况下,22.4L氦气含有所含的原子数约为6.02×1023
B.标准状况下,aL的二氧化碳和氮气的混合物含有的分子数约为![]() ×6.02×1023
×6.02×1023
C.22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数相同
D.标准状况下,2.24L CCl4中含有的原子数约为0.5×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)天然气是一种清洁高效的能源,其主要成分为甲烷。
CH4的摩尔质量为_____________, 4.8 g CH4的物质的量为______________,在标准状况下的体积约为_______________,所含氢原子数为_______________。
(2)某化学兴趣小组对某矿泉水进行检测, 发现0.5 L该矿泉水中含有10.8 mg Mg2+,则Mg2+的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用情性电极电解100ml0.5mol/L的CuSO4溶液、当阳极产生1.12L(标准状况)气体时,若要使电解质溶液恢复到电解前的状态,需加入的物质是( )
A. CuCO3B. CuOC. Cu(OH)2D. CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用图甲装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用__(填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是__。不能在K2的导管末端连接图乙中的__装置(填序号)。
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有__试剂和__试剂的洗气瓶。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为__。
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__溶液(填化学式),反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使酚酞变红的溶液:Na+、Al3+、SO42-、NO3-
B.![]() =10-12的溶液:NH4+、Na+、SO42-、Cl-
=10-12的溶液:NH4+、Na+、SO42-、Cl-
C.0.1 mol·L-1Na2SO3溶液:NH4+、K+、ClO-、Cl-
D.0.1 mol·L-1 FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com