
| A、随电子层数增多,原子得电子能力逐渐增强 |
| B、随原子半径增大,单质熔沸点升高 |
| C、最高价氧化物对应水化物碱性逐渐增强 |
| D、单质具有强还原性,其离子氧化性也强 |


科目:高中化学 来源: 题型:
| A、同周期的ⅡA族与ⅢA族的原子序数差只相差1 |
| B、第五周期所能容纳的元素种类有32种 |
| C、第十四列元素所在的族是第ⅣA族 |
| D、118号元素预测是金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W、Y、Z的氢化物稳定性顺序可能是W>Z>Y |
| B、W、X、Y、Z的原子半径大小顺序Z<Y<X<W |
| C、Z的氧化物对应水化物的酸性一定强于W氧化物对应水化物的酸性 |
| D、Z的某种氧化物可以做新型消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L H2O含有的分子数为1 NA |
| B、常温常压下,1 NA 个CO2分子占有的体积为22.4L |
| C、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 数目为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)═2H2O(l);△H1 | ||
B、C(s)+
| ||
| C、CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H3 | ||
| D、C(s)+O2(g)═CO2(g);△H4 | ||
| E、C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(g);△H5 | ||
| F、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H6 | ||
| G、2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l);△H7 | ||
| H、CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
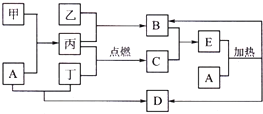
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液中加入氯化钙溶液:Ca2++CO32-═CaCO3↓ |
| B、实验室用石灰石制取CO2:CO32-2H+═H2O+CO2↑ |
| C、碳酸氢钙溶液跟盐酸反应:Ca2++2HCO3-+2H+═Ca2++2H2O+2CO2↑ |
| D、醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com