
将金属晶体的密堆积方式、对应的晶胞、配位数及其实例进行连线。
密堆积方式 对应的晶胞 配位数 实例
A1型 体心立方 8 Zn
A2型 六方 12 Ag
A3型 面心立方 12 Fe
科目:高中化学 来源: 题型:
下列性质适合于分子晶体的是( )
A.熔点1 070°C,易溶于水,水溶液能导电
B.熔点10.31°C,液态不导电,水溶液导电
C.难溶于CS2,熔点1 128°C,沸点4 446°C
D.熔点97.81°C,质软导电,密度0.97 g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知铁为面心立方晶体,其结构如下图甲所示,面心立方的结构特征如下图乙所示。若铁原子的半径为1.27×10-10m,试求铁金属晶体中的晶胞长度,即下图丙中AB的长度为____________m。
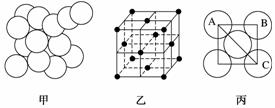
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.1个甘氨酸分子中存在9对共用电子
B.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
C.H2S和CS2分子都是含极性键的极性分子
D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
碱金属卤化物是典型的离子晶体,它们的晶格能与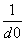 成正比(d0是晶体中最邻近的带有异性电荷离子的核间距)。下面说法错误的是( )
成正比(d0是晶体中最邻近的带有异性电荷离子的核间距)。下面说法错误的是( )
| 晶格能/kJ·mol-1 | 离子半径/pm | |
| ① | LiF LiCl LiBr LiI 1 031 845 807 752 | Li+ Na+ K+ 60 95 133 |
| ② | NaF NaCl NaBr NaI 915777 740 693 | F- Cl- Br- I- 136 181 195 216 |
| ③ | KF KCl KBr KI 812 708 676 641 |
A.晶格能的大小与离子半径成正比
B.阳离子相同、阴离子不同的离子晶体,阴离子半径越大,晶格能越小
C.阳离子不同、阴离子相同的离子晶体,阳离子半径越小,晶格能越大
D.金属卤化物晶体中,晶格能越小,还原性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的熔、沸点高低比较不正确的是( )
A.金刚石>二氧化硅>晶体硅
B.MgO>MgCl2>NaCl
C.金刚石>食盐>干冰
D.H2Se>H2S>H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨晶体具有一些独特的性质,质地较柔软但熔点很高,还具有导电性,这主要是因为石墨晶体具有一种独特的结构,石墨晶体是( )
A.原子晶体 B.金属晶体
C.分子晶体 D.混合键型晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+_______颜色(填“无”或“有”)。
(2)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为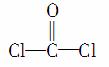 ,对其所存在的共价键,下列说法正确的是( )
,对其所存在的共价键,下列说法正确的是( )
A.4个σ键
B.2个σ键、2个π键
C.2个σ键、1个π键
D.3个σ键,1个π键
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5===Fe(s)+5CO↑,反应过程中,断裂的化学键只有____________。形成的化学键是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com