
分析 (1)甲基橙在酸性条件下显红色,达到滴定终点时变为橙色;
(2)加热煮沸目的是除去NaHSO3与氢离子反应生成SO2,SO2与KMnO4能发生氧化还原反应,使消耗的KMnO4的体积偏大;KMnO4具有强氧化性能腐蚀碱式滴定管;
(3)实验I中,n(NH3)=n(HCl)-n(NaOH),
实验II中发生的反应:V10O286-+5HSO3-+21H+=10VO2++5SO42-+13H2O,5VO2++MnO4-+H2O=Mn2++5VO2++2H+,
则V10O286-~10VO2+~2MnO4-,根据高锰酸钾的物质的量求出V10O286-的物质的量,利用物质的量之比等于微粒数目比求出x,再根据质量守恒定律求出水的质量和n的值.
解答 解:(1)用0.1000mol/LNaoH标准溶液滴定剩余的HCl标准溶液,待测溶液和甲基橙盛放在锥形瓶中,甲基橙在酸性条件下显红色,然后用氢氧化钠滴定,达到滴定终点时变为橙色,所以当滴入最后一滴NaOH标准溶液时,溶液颜色由红色变为橙色,且半分钟内不变色,说明达到滴定终点;
故答案为:当滴入最后一滴NaOH标准溶液时,溶液颜色由红色变为橙色,且半分钟内不变色;
(2)由题中信息可知,NaHSO3与氢离子反应生成SO2,所以加热煮沸目的是除去反应生成SO2,若没有改操作,则SO2与KMnO4能发生氧化还原反应,使消耗的KMnO4的体积偏大,根据方程式计算得到的V10O286-物质的量偏大,所以测定结果偏高;KMnO4具有强氧化性能腐蚀碱式滴定管,所以要用酸式滴定管盛放高锰酸钾溶液;
故答案为:偏高;酸式滴定管;
(3)实验I中,n(NH3)=n(HCl)-n(NaOH)=0.0500L×0.1000mol/L-0.0200×0.1000mol/L=0.003mol,
实验II中发生的反应:V10O286-+5HSO3-+21H+=10VO2++5SO42-+13H2O,5VO2++MnO4-+H2O=Mn2++5VO2++2H+,
则V10O286-~10VO2+~2MnO4-,所以n(V10O286-)=$\frac{1}{2}$n(MnO4-)=$\frac{1}{2}$×0.075L×0.02mol/L=0.00075mol,
n(V10O286-):n(NH4+)=1:x,所以x=4,
化合物A的摩尔质量为M=$\frac{0.9090g/mol}{0.00075mol}$=1212g/mol,
n=$\frac{1212-18×4-1×2-51×10-16×28}{18}$=10,
所以A的化学式为:(NH4)4H2V10O28•10H2O.
答:十钒酸铵晶体的化学式为:(NH4)4H2V10O28•10H2O.
点评 本题考查了物质含量的测定,侧重于氧化还原反应滴定法的应用以及误差分析的考查,题目难度中等,注意把握滴定原理以及误差分析的方法,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
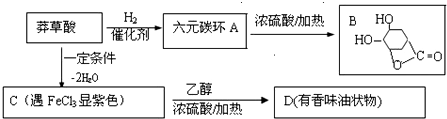
 .
. +CH3CH2OH$→_{△}^{浓硫酸}$H20+
+CH3CH2OH$→_{△}^{浓硫酸}$H20+ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
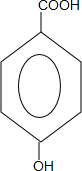
 近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 1mol苹果酸和足量的钠反应生成1.5moL的H2 | |
| D. | 1mol苹果酸与Na2CO3溶液反应必需消耗2mol Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
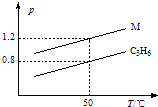 图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )
图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )| A. | SO2 | B. | CO2 | C. | C3H8 | D. | CO和N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相等、电子数和原子数不相等:① | |
| B. | 质子数和电子数相等、原子数不相等:② | |
| C. | 电子数相等、质子数和原子数不相等:③ | |
| D. | 原子数和电子数相等、质子数不相等:④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
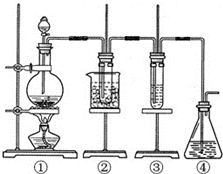 某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:
某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com