
分析 甲烷、氧气和氢氧化钾溶液构成燃料电池,甲烷易失电子发生氧化反应,则甲烷所在电极为负极,氧气所在电极为正极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子,据此分析.
解答 解:(1)甲烷、氧气和氢氧化钾溶液构成燃料电池,甲烷易失电子发生氧化反应,则甲烷所在电极为负极,氧气所在电极为正极,负极上电极反应式为CH4+10OH--8e-=CO32-+7H2O,该极消耗氢氧根离子,所以溶液的pH减小;
故答案为:负极;减小;
(2)正极上氧气得电子和水反应生成氢氧根离子,正极上电极反应式为O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(3)碱性条件下,氧气和甲烷反应生成碳酸根离子和水,则电池反应离子方程式为:CH4+2OH-+2O2=CO32-+3H2O,
故答案为:CH4+2OH-+2O2=CO32-+3H2O.
点评 本题考查了化学电源新型电池,根据得失电子确定正负极上通入的气体,难点是电极反应式的书写,注意碱性条件下甲烷失电子不能生成二氧化碳,要生成碳酸根离子,为易错点,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH2-Cl | B. | 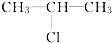 | C. | CH3CH2CH2-Br | D. | 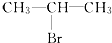 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | K=6.61×10-4 |
| A. | 氰化钠溶液中通入少量CO2:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN-)>c(HCN)>c(H+)>c(OH+) | |
| C. | 0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液中各种离子的浓度关系有:2[c(H+)-c(OH+)]=c(CN+)-c(HCN) | |
| D. | 等体积、等浓度的NaCN和NaF溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12mol2•L-2 | B. | 16mol2•L-2. | C. | 20mol2•L-2 | D. | 25mol2•L-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷可与氯气反应制取纯净的一氯乙烷 | |
| B. | 乙烯可以使溴水褪色 | |
| C. | 乙烷和乙烯互为同分异构体 | |
| D. | 乙烯制备聚乙烯是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量大于形成2molH-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
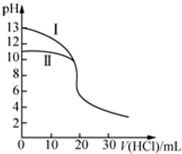
| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且c(NH4+)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3•H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com