
| A. | 将20gNaOH溶解在500mL水中 | |
| B. | 将22.4L HCl气体溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1浓盐酸加入9L水中 | |
| D. | 将10gNaOH溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250mL |
分析 结合n=$\frac{m}{M}$、n=$\frac{V}{Vm}$、c=$\frac{n}{V}$计算.
解答 解:A.500mL水为溶剂的体积,溶液体积未知,不能计算浓度,故A不选;
B.状况未知,Vm不确定,不能利用体积计算,故B不选;
C.加入9L水中,溶液的体积不是10L,故C不选;
D.将10gNaOH溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250mL,则NaOH的浓度为$\frac{\frac{10g}{40g/mol}}{0.25L}$=1mol/L,故D选;
故选D.
点评 本题考查物质的量浓度的计算,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意状况及溶液体积的判断,题目难度不大.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | N三N | N-H |
| 键能/(kJ•mol-1) | 436 | 945.6 | 391 |
| A. | +192.4 kJ•mol-1 | B. | +92.4kJ•mol-1 | C. | -92.4kJ•mol-1 | D. | -192.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
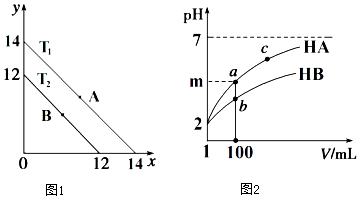 (1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.
(1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为AlCl3,则丁可能是浓氨水 | ||
| C. | 若甲为SO2,则丁可能是氨水 | D. | 若甲为NaOH 溶液,则丁可能是H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分别加入碘化钾溶液,观察颜色变化 | |
| B. | 分别加热,观察是否生成沉淀 | |
| C. | 分别滴加浓硝酸 | |
| D. | 分别灼烧,闻味道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热为221KJ/mol | |
| B. | 稀盐酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热值为57.3KJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com