
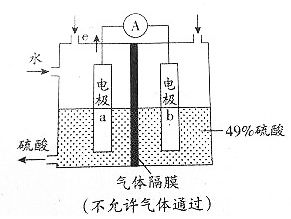
| A. | 该装置工作时能将化学能转化为电能,并有H2SO4生成 | |
| B. | 电极b表面O2发生还原反应,电极b附近溶液的pH升高 | |
| C. | 气体样品从电极a区域通入,样品中的SO2在电极a表面得到电子 | |
| D. | 电极a表面发生的电极反应时为SO2+2H2O-2e-=${SO}_{4}^{2-}$+4H+ |
分析 由图可知总反应是二氧化硫、氧气与水反应生成硫酸,没有外接电源,是原电池装置,电极a是电子流出的一极,则a作负极,b作正极;二氧化硫通入负极a,失去电子发生氧化反应生成SO42-,电极反应式为:SO2+2H2O-2e-═SO42-+4H+;氧气通入正极b,得电子结合氢离子生成水,电极反应式为:O2+4H++4e-═2H2O,据此分析解答.
解答 解:A.该装置没有外接电源,是原电池装置,工作时能将化学能转化为电能,总反应是二氧化硫、氧气与水反应生成硫酸,故A正确;
B.电极b上是氧气得电子发生还原反应,电解质溶液为49%的硫酸,则电极反应式为:O2+4H++4e-═2H2O,氢离子被消耗,pH值升高,故B正确;
C.电极a是电子流出的一极,则a作负极,二氧化硫通入负极a,失去电子发生氧化反应生成SO42-,故C错误;
D.电极a上是二氧化硫失去电子被氧化成SO42-,电极反应式为:SO2+2H2O-2e-═SO42-+4H+,故D正确;
故选C.
点评 本题考查了原电池原理的应用,注意把握电路中电子的移动方向,明确电极方程式的书写方法是解决本题的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法判断是哪一类元素 | B. | 一定是稀有气体元素 | ||
| C. | 一定是过渡元素 | D. | 一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数之和是质子数之和两倍的水分子符号可能是D${\;}_{2}^{16}$O | |
| B. | Mg的原子结构示意图为 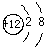 | |
| C. | 次氯酸的电子式为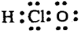 | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:OH-+HCO3一═H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在游泳池中常加CuSO4和漂白粉,它们使细菌蛋白质变性的原理相同 | |
| B. | 铜制品在潮湿空气中生锈,其主要原因是发生吸氧腐蚀 | |
| C. | “地沟油”禁止食用,但可以用来制肥皂,是利用了皂化反应 | |
| D. | 利用K2FeO4作水处理剂是因为它既有吸附性又有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| B. | 已知电离常数H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| D. | 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com