
| A. | 若金属有剩余,在溶液中再滴入硫酸后,金属不溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若金属全部溶解,则溶液中一定含有Fe2+ | |
| D. | 若金属有剩余,不可能只有铁 |
分析 A.稀硫酸和铜不反应,但酸性条件下,硝酸根离子和铜反应;
B.若金属全部溶解,溶液中不一定含有铁离子;
C、若金属全部溶解,则溶液中不一定含有Fe2+,可能是铁离子与铜离子;
D、如果剩余金属是铁,要与溶液中的铜离子反应生成单质铜.
解答 解:Fe+2H++NO3-=Fe 3++NO↑+H2O、3Cu+8H++2NO3-=3Cu 2++4H2O+2NO↑、Fe+2Fe3+=3Fe2+ Cu+2Fe3+=2Fe2++Cu2+,
A.若金属有剩余,原溶液中存在硝酸根离子,在溶液中再滴入硫酸后,溶液中相当于又有硝酸,所以金属又开始溶解,故A错误;
B.若金属全部溶解,如果铜和铁离子完全反应,则溶液中一定不含Fe3+,可能含有亚铁离子和铜离子,故B错误;
C、若金属全部溶解,则溶液中不一定含有Fe2+,可能是铁离子与铜离子,故C错误;
D、如果剩余金属是铁,要与溶液中的铜离子反应生成单质铜,所以若金属有剩余,不可能只有铁,可能是铁和铜的混合物,也可能全是铜,故D正确;
故选D.
点评 本题考查硝酸的性质,明确金属反应先后顺序是解本题关键,易错选项是A,注意:酸性条件下硝酸根离子具有强氧化性,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 金属钠久置于空气中,先变暗,再变白,又“出汗”,最后变成白色固体 | |
| B. | 由海水制备金属镁和游离态的溴 | |
| C. | 工业上用石灰石、石英、纯碱制玻璃 | |
| D. | 高温下用二氧化硅和碳反应制备粗硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
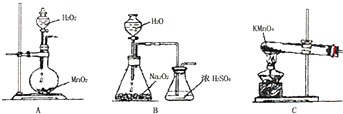
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.46g | B. | 0.69g | C. | 0.92g | D. | 0.23g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均为0.56 L | B. | ①=② | C. | ①>② | D. | ②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
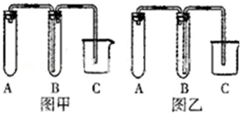 化学是一门以实验为基础的学科.
化学是一门以实验为基础的学科.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出4.0g固体,配成1L溶液,请计算:
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出4.0g固体,配成1L溶液,请计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com