
【题目】C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Si的原子核外价电子排布图为___________________________
(2)金刚石的结构是正四面体则其中的碳原子杂化方式是_______________
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式____________________________;
②CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为__________;
③乙烯的分子是C2H4,是根据其结构推断是_________分子(填 “极性”或“非极性”)
(4)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度__________(填字母)
A.强 B.弱 C.相等 D.无法判断
【答案】略 sp3 直线形,共价键(或σ键与π键) 配位键 非极性 B
【解析】
(1)硅的原子核外价电子排布图为![]() 。
。
(2)金刚石的晶体中每个碳原子都和其他四个碳原子构成正四面体结构,碳原子的杂化方式为sp3。
(3)①CO2分子的空间构型是直线型,碳原子和每个氧原子之间都通过两对共用电子结合,形成碳氧双键,其中一个是σ键,一个是π键。故答案为:直线形,共价键(或σ键与π键)。
②金属配合物里,金属原子提供空轨道,CO提供孤电子对,Ni与CO之间形成配位键。
③乙烯是平面四边形结构,正负电荷中心重合,是非极性分子。
(4)碳氧键的红外伸缩振动频率与键的强度成正比, Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,小于CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度弱,故选B。


科目:高中化学 来源: 题型:
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g) △H1
已知:①CH4、H2、CO的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O(l)=H2O(g);△H=+d kJmol-1
则△H1=____(用含字母a、b、c、d的代数式表示)kJmol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2____(填“>”“<”或“ = ”)0。
②下列说法正确的是____(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=____mol L-1·min-1。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2mol CO、2mol H2、2mol CH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是______________。
(2)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S。只由离子键构成的物质是_________;只由极性共价键构成的物质是_____;由极性键和非极性键构成的物质是_______;由离子键和极性键构成的物质是_______。(填序号)。
(3)写出下列物质的电子式:CaF2:______________CO2:______________ NH4Cl:________________。
(4) 用电子式表示下列化合物的形成过程:H2S:__________________________________;MgCl2:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:邻苯二甲酸(H2A)的Ka1=1.1×10-3,Ka2=3.9×10-6。室温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1邻苯二甲酸氢钾(KHA)溶液。下列说法正确的是( )
A.0.1 mol·L-1 KHA溶液中:c(K+)>c(HA-)+2c(A2-)
B.加入NaOH溶液至pH=8时:c(K+)>c(A2-)>c(HA-)>c(H2A)
C.加入20 mL NaOH溶液时:c(OH-)+c(A2-)=c(Na+)+c(H+)+c(H2A)
D.在滴定过程中,水的电离程度一直减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置的叙述正确的是( )
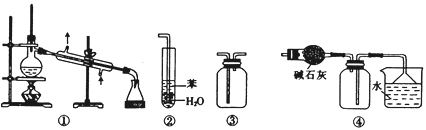
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②用于吸收NH3或HCl气体时,易形成倒吸
C. 装置③可用于收集H2、CO2、Cl2、NH3、C2H4等气体
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co3O4(Co为+2和+3价)可应用于磁性材料等领域。实验室利用乙酸钴晶体[Co(CH3COO)2·4H2O]制备Co3O4的实验步骤如下:
Ⅰ. 将乙酸钴晶体配成溶液X,缓慢滴加(NH4)2CO3溶液,30 ℃水浴一段时间;
Ⅱ. 将混合液高压密封加热到160 ℃,得到含碱式碳酸钴晶体[2CoCO3·3Co(OH)2·H2O]的浊液;
Ⅲ. 制备碱式碳酸钴晶体;
Ⅳ. 将碱式碳酸钴晶体在空气中煅烧得Co3O4产品。
已知:碱式碳酸钴晶体不溶于冷水和乙醇,可溶于温水,常压下高于30 ℃开始分解。
(1) 乙酸钻晶体中钴含量可用配位滴定法测定,下列说法正确的是________(填字母)。
a. 滴定前,锥形瓶和滴定管均须用标准溶液润洗
b. 读数前,需排除滴定管尖嘴处的气泡
c. 滴定时,眼睛注视锥形瓶中颜色变化
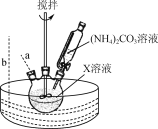
(2) “步骤Ⅰ”30 ℃水浴的装置如右图所示,温度计应置于________(填“a”或“b”)处。
(3) “步骤Ⅱ”采用高压密封加热的目的是________。
(4) “步骤Ⅳ”中,在实验室煅烧碱式碳酸钴晶体所需的仪器除酒精灯、三脚架以外,还需要的硅酸盐质仪器有____________,煅烧时发生反应的化学方程式为________。
(5) “步骤Ⅲ”中,设计由“步骤Ⅱ”的浊液制备碱式碳酸钴晶体的实验方案:________________________。(实验须使用的试剂:蒸馏水、乙醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡
时,下列说法正确的是( )
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的正反应速率是Y的逆反应速率的m/n倍
C. 降低温度,混合气体的平均相对分子质量变小
D. 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法正确的是 ( )

A.金刚石比石墨稳定
B.红磷转变为白磷是吸热反应
C.S(g)+O2(g) === SO2(g) ΔH1 ;S(s)+O2(g) === SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g) === CO2(g)+H2(g) ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com