
| A、丙烷和丁烷均属于烷烃 |
| B、两者分子中均含有碳碳双键 |
| C、丙烷和丁烷燃烧均是放热反应 |
| D、丙烷和丁烷充分燃烧均生成二氧化碳和水 |
科目:高中化学 来源: 题型:
 如图是现今常规生产发烟硫酸和硫酸的流程图:
如图是现今常规生产发烟硫酸和硫酸的流程图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12C的相对原子质量为12g?mol-1 |
| B、MgCl2的摩尔质量是95 g |
| C、0.5 mol氢元素约含6.02×1023个氢原子 |
| D、NA常数约为6.02×1023 mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用焰色反应可鉴别KC1溶液和NaCl溶液 |
| B、利用丁达尔效应可鉴别溶液和胶体 |
| C、运用过滤的方法,可以分离泥沙和氯化钠溶液混合物 |
| D、用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、①③⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
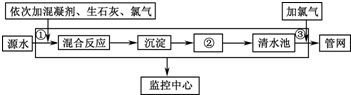 如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.
如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com