
【题目】已知:断裂1 mol C=C键、1 mol C-H键、1 mol H-H键、1 mol C-C键吸收的能量分别为615 kJ、413.5 kJ、436 kJ、347 kJ;键能是指气态基态原子形成1 mol化学键释放的最低能量,单位为kJ·mol-1,乙烯转化为乙烷的过程如图所示,下列说法正确的是

A.C=C键的键能小于C-C键的键能
B.由乙生成1 mol丙时放出的能量为2001 kJ
C.CH2=CH2(g)、H2(g)反应生成1 mol CH3CH3(g)时放出的能量为123 kJ
D.甲、乙、丙中物质含有的总能量大小关系为乙>丙>甲
【答案】C
【解析】
A. C=C键键能为615 kJ/mol,C-C键键能为347 kJ/mol,所以C=C键的键能大于C-C键的键能,A错误;
B.形成化学键释放能量,则由乙生成1 mol丙时放出的能量为(347+413.5×6) kJ=2828 kJ,B错误;
C. 焓变等于断裂化学键吸收的能量减去成键释放的能量,则CH2=CH2+H2→CH3CH3反应的△H=(615+413.5×4+436-347-413.4×6)kJ/mol=-123 kJ/mol,C正确;
D.断键吸收变为单个气态原子吸收热量,使物质的内能增加,则物质能量:乙>甲;形成化学键释放能量,物质的内能减小,则物质含有的能量乙>丙;根据选项C可知物质甲变为丙放出热量,说明甲的能量比丙高,故甲、乙、丙中物质含有的总能量大小关系为乙>甲>丙,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
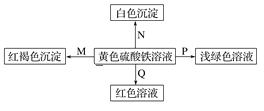
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 铁粉 | KSCN |
D | Na2O2 | MgCl2 | 锌粉 | KSCN |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①Ar ②Na2O2 ③CCl4 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
(1)只存在共价键的是_______,不存在化学键的是_______,离子化合物有________。
(2)NH4Cl的电子式为_________。
(3)用电子式表示MgF2的形成过程___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备:C4H10(g)![]() C4H8(g)+H2(g) △H。该反应平衡转化率、反应温度及压强的关系如图,下列说法正确的是
C4H8(g)+H2(g) △H。该反应平衡转化率、反应温度及压强的关系如图,下列说法正确的是
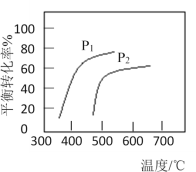
A.该反应△S<0
B.压强P1<P2
C.该反应为吸热反应,平衡常数随温度升高而降低
D.使用催化剂可加快反应速率,使平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3可用于生产硝酸和尿素。
(1)生产硝酸:
①NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是______________。
②除此之外,相同条件下还可能发生以下副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) ![]()
4NH3(g)+3O2(g)=2N2O(g)+6H2O(g) ![]()
两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是______________。
(2)生产尿素:
①尿素的合成分两步进行;
a.2NH3(g)+CO2(g)![]() NH2COONH4(l)
NH2COONH4(l) ![]()
b.NH2COONH4(l)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) ![]()
则总反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)的
CO(NH2)2(l)+H2O(l)的![]() =_____________。
=_____________。
②下图为n(NH3):n(CO2)=4:1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:______________。

③测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,海水资源的利用前景广阔,从海水中提取镁的主要步骤如图所示,下列说法正确的是
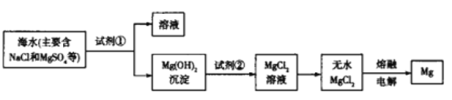
A.工业上利用NaOH溶液使Mg2+转化为Mg(OH)2
B.与Mg同周期的金属都可以采用电解熔融的无水氯化物来制备
C.试剂②可以选用盐酸
D.工业上也可以将Mg(OH)2煅烧分解为MgO,通过电解熔融MgO制取Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着现代科学技术的快速发展,防腐蚀技术也在不断提高。
Ⅰ.金属的腐蚀原理
(1)中性环境中多为吸氧腐蚀,其正极的电极反应为________。
(2)析氢腐蚀和吸氧腐蚀的均会导致体系中c(OH-)________(填“增大”、“不变”或“减小”)。
(3)不同酸性介质中,金属腐蚀原理并不相同。下图是密闭容器中,生铁在pH=2和pH=4的盐酸中压强随时间的变化过程。
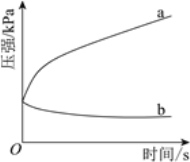
图中代表pH=2的曲线是________(填“a”或“b”)。
Ⅱ.金属的电化学防护
(1) 富锌涂料是使用广泛的防锈底漆,涂层中锌对钢铁保护的原理是________。
(2) 缓蚀剂是能明显减缓或阻止金属腐蚀的物质,钼酸钠(Na2MoO4)和磷酸二氢锌[Zn(H2PO4)]2是常用自来水(pH范围6.5~8.8)介质碳钢缓蚀剂。
①钼酸钠(Na2MoO4)在电极表面被还原为MoO2形成保护膜,减缓腐蚀,该电极反应为______;同时,MoO42-能与Fe2+反应生成难溶的Fe2O3和MoO2,沉积在碳钢表面减缓腐蚀。写出MoO42-与Fe2+反应的离子反应方程式:_______。
②电化学反应可使缓蚀剂成分中的Zn(H2PO4)2转化为难溶性的Zn3(PO4)2,形成保护膜,减缓腐蚀。用平衡移动原理解释发生转化原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
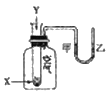
【题目】某学生用如图所示装置进行化学反应X+Y=Z能量变化情况的研宄。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述:①该反应为放热反应②生成物的总能量比反应物更高③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来,其中正确的是( )
A.①②③
B.①③
C.①②
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示。

下列关于二氧化硅晶体的说法不正确的是( )
A. 晶体中每个硅原子与4个氧原子相连
B. 晶体中硅、氧原子个数比为1∶2
C. 晶体中最小环上的原子数为8
D. 晶体中共用一个硅原子的最小的环的原子数目为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com