
分析 (1)已知:①CH3OCH3(g)+H2O(g)?2CH3OH(g)△H=+akJ/mol
②CH3OH(l)+H2O(g)?CO2(g)+3H2(g)△H=+bkJ/mol
据盖斯定律,①+②×2得:CH3OCH3(g)+3H2O(g)?2CO2(g)+6H2(g);
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小;
(3)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
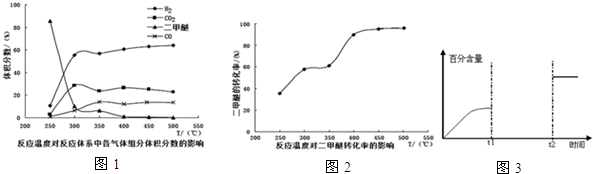
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,氢气的体积分数最大;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同;
(5)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加.
解答 解:(1)已知:①CH3OCH3(g)+H2O(g)?2CH3OH(g)△H=+akJ/mol
②CH3OH(l)+H2O(g)?CO2(g)+3H2(g)△H=+bkJ/mol
据盖斯定律,①+②×2得:CH3OCH3(g)+3H2O(g)?2CO2(g)+6H2(g),△H=+(a+2b)kJ/mol,
故答案为:CH3OCH3(g)+3H2O(g)?2CO2(g)+6H2(g),△H=+(a+2b)kJ/mol;
(2)反应③CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$,正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,
故答案为:$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$;减小;
(3)A.均为气体,混合气体总质量不变,容器容积不变,容器内气体的密度始终不变,故A错误;
B.混合气体总质量不变,随反应进行混合气体物质的量增大,平均相对分子质量减小,所以平均相对分子质量保持不变时,说明达到了化学平衡状态,故B正确;
C.CO的体积分数不变,说明反应到达平衡,故C正确;
D.CO与氢气的物质的量之比始终是1:2,不能证明达到了化学平衡状态,故D错误.
故选:BC;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,氢气的体积分数最大,故选:C;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2?3H2+3CO,
故答案为:CH3OCH3+CO2?3H2+3CO;
(5)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,图象为: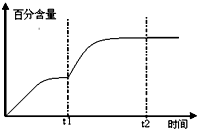 ,
,
故答案为: .
.
点评 本题考查较为综合,涉及盖斯定律的应用、化学平衡常数及其影响因素、平衡状态的判断、化学平衡影响因素、读图获取信息的能力等,是对学生综合能力的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ | |
| B. | 向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| C. | 向某溶液中滴加足量稀HCl,产生的气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| D. | 加入硝酸钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,则说明原溶液中一定有离子SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
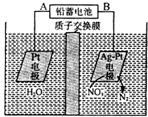
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池放电时负极质量增加 | |
| C. | 该电解池的阴极反应为:2NO3-+12H++10e-═N2↑十6H2O | |
| D. | 若电路中流过2 mol电子,则阳极室溶液质量减少32g(忽略气体的溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1,可知CO的标准燃烧热为:566kJ•mol-1 | |
| B. | 含溶质0.5mol的浓硫酸和含溶质1mol的NaOH的稀溶液完全反应放出的热量为中和热 | |
| C. | 氯化钾中混有少量的硝酸钾,可用溶解、蒸发结晶、趁热过滤的方式来提纯氯化钾 | |
| D. | 淀粉和硫酸的混合溶液加热一段时间后,检验水解液中是否有淀粉时,可取少量水解液于试管中,加入足量的强氧化钠溶液处理,最后滴加少量碘水检验是否有淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将亚硫酸钠溶液在空气中蒸干、灼烧,得到的物质的主要成分是亚硫酸钠 | |
| B. | 硝酸亚铁溶液中加入一定量的盐酸可抑制Fe2+的水解,提高Fe2+的浓度 | |
| C. | 室温下OH-浓度相同的醋酸钠和碳酸钠的溶液加水稀释相同的倍数后,碳酸钠溶液的碱性弱 | |
| D. | 25℃,HCN的电离平衡常数Ka=5.0×10-10,同浓度的HCN和NaCN的混合溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混凝剂具有强氧化性 | |
| B. | Al2(OH)nClm•yH2O化学式中m等于3-n | |
| C. | 若(2)中Cl2化学计量数为a,则AgF的化学计量数为3a | |
| D. | 若(2)中AgClO3、O2的化学计量数分别为b、c,则AgCl的化学计量数为5b+4c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 向氯化亚铁溶液滴加新制氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 铁和稀盐酸反应:2Fe+6H+═3H2↑+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com