
分析 铁粉和氧化铁的混合物中加入稀硫酸,恰好完全反应,放出氢气,并测得溶液中无Fe3+,则无固体剩余物,则最终溶液中溶质为FeSO4,发生反应:Fe+Fe2O3+3H2SO4=3FeSO4+3H2O、Fe+H2SO4=FeSO4+H2↑,计算生成4.48L氢气时消耗Fe、H2SO4的物质的量,设原混合物中Fe2O3的物质的量为xmol,根据化学方程式表示出与氧化铁反应消耗Fe、H2SO4的物质的量,再根据混合物总质量列方程计算.
解答 解:铁粉和氧化铁的混合物中加入稀硫酸,恰好完全反应,放出氢气,并测得溶液中无Fe3+,则无固体剩余物,则最终溶液中溶质为FeSO4,
反应生成 H2的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,则:
Fe+H2 SO4=FeSO4+H2↑
0.1mol 0.1mol 0.1mol
设原混合物中Fe2O3的物质的量为xmol,则:
Fe+Fe2O3+3H2SO4=3FeSO4+3H2O
x mol x mol 3x mol
由题意可知:(x+0.1)mol+x mol=0.6mol,
解得x=0.25mol,
答:原混合粉末中铁和氧化铁的物质的量各为0.35mol和0.25mol.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的实质为解题关键,注意根据方程式解答,侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
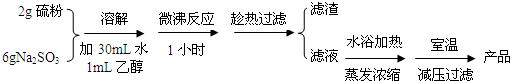
| 组号 | 反应温度(℃) | Na2S2O3 | H2O | H2SO4 | ||
| V/mL | c/mol•L-1 | V/mL | V/mL | c/mol•L-1 | ||
| ① | 10 | 10 | 0.1 | 0 | 10 | 0.1 |
| ② | 10 | 5 | 0.1 | 5 | 10 | 0.1 |
| ③ | 30 | 10 | 0.1 | 0 | 10 | 0.1 |
| ④ | 30 | 5 | 0.1 | 5 | 10 | 0.1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),EVA
),EVA| A. | EVA材质属于高分子化合物材质 | |
| B. | NH3溶于水能导电,所以NH3是电解质 | |
| C. | 甲酰胺的摩尔质量为45 | |
| D. | 甲酰胺分解生成CO和NH3属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图锥形瓶中装满了c mol•Lˉ1的Na2SO4溶液,经测定其中含有a mol Na+,则锥形瓶容
如图锥形瓶中装满了c mol•Lˉ1的Na2SO4溶液,经测定其中含有a mol Na+,则锥形瓶容| A. | $\frac{a}{c}$ L | B. | $\frac{a}{2c}$L | C. | ac L | D. | 2ac L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的溶液中:Na+Mg2+CH3COO-SO42- | |
| B. | PH=13的溶液中:Ba2+K+Cl-HCO3- | |
| C. | 无色溶液中:K+Fe3+CO32-NO3- | |
| D. | 透明溶液中:Na+NH4+NO3-MnO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com