
【题目】我国科学家通过测量SiO2中的26Al和10Be两种元素的比例确定“北京人”年龄,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)写出Be的核外电子排布式_______________。Be所在的周期中,最外层有2个未成对电子的元素的符号是_______、_________。
(2)写出Al的最外层电子轨道表示式__________________。铝原子核外有_______种运动状态不同的电子;铝原子核外有_______中能量不同的电子。
(3)比较Al3+、S2-和Cl-半径由大到小的顺序_________________________;这3种元素最高价氧化物对应的水化物中酸性最强的是___________(写化学式)。
(4)铝元素最高价氧化物与氢氧化钠溶液反应的化学方程式______________________________。
【答案】1s22s2 C O ![]() 13 5 S2->Cl->Al3+ HClO4 Al2O3+2NaOH→2NaAlO2+H2O
13 5 S2->Cl->Al3+ HClO4 Al2O3+2NaOH→2NaAlO2+H2O
【解析】
(1)Be的原子序数为4,位于第二周期第ⅡA,写出核外电子排布式,与Be所在的周期中,最外层有2个未成对电子的元素是C:1s22s22p2,O:1s22s22p4;
(2)Al的最外层有3个电子,电子排布式为1s22s22p6s23p1;铝原子核外有13种运动状态不同的电子;铝原子核外电子排布为1s22s22p63s23p1,五种轨道,五种能量。
(3)比较微粒半径①电子层越多,半径越大②当电子层数相同时,核电荷数越大,吸电子能力越强,半径越小;元素非金属性越强,最高价氧化物水化物酸性越强。
(4)铝元素最高价氧化物为Al2O3可以与氢氧化钠反应生成偏铝酸钠与水。
(1)Be的原子序数为4,位于第二周期第ⅡA,核外电子排布式为1s22s2,与Be所在的周期中元素C:1s22s22p2,O:1s22s22p4,2p轨道均有2个未成对电子;
答案:1s22s2 C O
(2)Al的最外层有3个电子,电子排布式为3s23p1,则最外层电子轨道表示式为![]() ;铝原子核外有13个电子则有13种运动状态不同的电子;铝原子核外电子排布为1s22s22p63s23p1,五种轨道,五种能量;
;铝原子核外有13个电子则有13种运动状态不同的电子;铝原子核外电子排布为1s22s22p63s23p1,五种轨道,五种能量;
答案:13 5
(3)比较半径①电子层越多,半径越大②当电子层数相同时,核电荷数越大,吸电子能力越强,半径越小,因此离子半径 S2->Cl->Al3+;元素非金属性越强,最高价氧化物水化物酸性越强,氯元素的非金属性最强,则 HClO4酸性最强。
答案: HClO4
(4)铝元素最高价氧化物为Al2O3可以与氢氧化钠反应生成偏铝酸钠与水,方程式为 Al2O3+2NaOH→2NaAlO2+H2O;
答案: Al2O3+2NaOH→2NaAlO2+H2O


科目:高中化学 来源: 题型:
【题目】党的十九大报告中多次提及“绿色环保”“生态文明”,而CO2的有效利用可以缓解温室效应,解决能源短缺问题。中科院大连化学物理研究所的科研人员在新型纳米催化剂Na—Fe3O4和HMCM—22的表面将CO2转化为烷烃,其过程如图。

上图中CO2转化为CO的反应为:CO2(g)+H2(g)=CO(g)+H2O(g) △H =+41kJ/mol
已知:2CO2(g)+6H2(g)= C2H4(g)+ 4H2O(g) △H =-128kJ/mol
(1)图中CO转化为C2H4的热化学方程式是______________________。
(2)Fe3O4是水煤气变换反应的常用催化剂,可经CO、H2还原Fe2O3制得。两次实验结果如表所示:
实验I | 实验II | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用______________________。
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如图所示,电极a接电源的____________极(填“正”或“负”),生成甲醇的电极反应式是______________________。
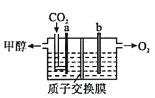
(4)用CO、H2生成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
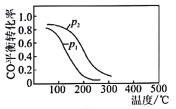
①△H2______________(填“>”“<”“=”)0。
②写出两条可同时提高反应速率和CO转化率的措施______________________________________。
③下列说法正确的是___________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充人稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3min内用CH3OH表示的反应速率v(CH3OH)=____________mol·L-1·min-1
⑤200℃时,该反应的平衡常数K=_____________。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变则化学平衡__________(填“正向”“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知最简单的有机物E和直线型分子G在光照条件下反应,生成四面体型分子L和直线型分子M(组成G分子的元素为第三周期的元素),如下图。则下列判断错误的是
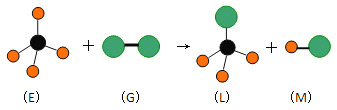
A. 常温常压下,E是一种无色无味的气体
B. 上述反应类型是加成反应
C. 在光照条件L能与 G继续发生与上述类似的反应
D. 上述反应类型是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年,全球发生了禽流感。我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式如下图,下列有关金丝桃素说法错误的是
![]()
A. 分子式为C17H23NO3
B. 苯环上的一氯取代物有3种
C. 可以发生取代、加成、酯化等反应
D. 1mol金丝桃素最多能和4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:
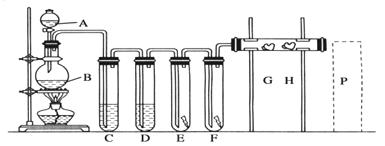
![]() 仪器的名称: ________。B中发生反应的化学方程式为____________。
仪器的名称: ________。B中发生反应的化学方程式为____________。
![]() 为了获得纯净干燥的氯气, C、D中应分别放入的试剂C为_________,作用是________________________;D中为___________。
为了获得纯净干燥的氯气, C、D中应分别放入的试剂C为_________,作用是________________________;D中为___________。
![]() 中为红色干布条,F中为红色湿布条,可观察到有色布条褪色的是______
中为红色干布条,F中为红色湿布条,可观察到有色布条褪色的是______![]() 填E或
填E或![]()
![]() 是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成__________,H是浸有NaBr溶液的棉花球,H处发生的离子方程式为_________________。
是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成__________,H是浸有NaBr溶液的棉花球,H处发生的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期元素aX、bY、cZ、dR、eW存在如下关系:① X、Y同主族,R、W同主族 ②![]() ;a+b=
;a+b=![]() (d+e);
(d+e);![]() =c-d,下列有关说法不正确的是
=c-d,下列有关说法不正确的是
A.原子半径比较:r(W)>r(Z)>r(Y) >r(R)
B.X和Y形成的化合物中,阴阳离子的电子层相差1层
C.W的最低价单核阴离子的失电子能力比R的强
D.Z、Y最高价氧化物对应的水化物之间可以相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )

A. 升高温度能使![]() 增大
增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取Na2CO3和NaOH的混合液100mL,先向其中滴加Ba(OH)2溶液至不产生沉淀为止,再向其中滴加稀盐酸至沉淀消失,产生的沉淀的质量与消耗盐酸的体积如图所示:
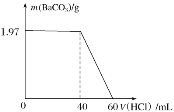
(1)原混合液中Na2CO3与NaOH的物质的量浓度比为___。
(2)稀盐酸的物质的量浓度为___mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com