
| 重要现象或事实 | 所得结论 |
| 能用小刀切割金属钠 | ① |
| ② |
金属钠的熔点低 |
| ③ |
属钠与水反应有碱生成 |
| ④ |
金属钠与水反有气体生成 |
| 金属钠加入水中,浮在水面上 | ⑤ |
| 小刀切开金属的面,金属光泽迅速变暗 | ⑥ |
| 过氧化钠加入水中,所得气体使带火星的木条复燃 | ⑦ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、化学反应中的能量变化除了热量外还可以是光能、电能等 |
| B、需要加热才能进行的化学反应一定是吸热反应 |
| C、化学反应过程中的能量变化服从能量守恒定律 |
| D、生成物的总能量小于反应物的总能量时发生的是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向盐酸中加入适量氨水:H++OH-=H2O |
| B、铁与足量稀HNO3反应:3Fe+8H++2NO3-=3 Fe2++2NO↑+4H2O |
| C、氢氧化铜溶于硝酸:2H++Cu(OH)2=Cu2++2H2O |
| D、铜与浓HNO3反应:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光 |
| 叶绿体 |
| A、反应后溶液的pH降低 |
| B、每生成1mol O2转移4mol电子 |
| C、叶绿体被氧化 |
| D、该实验可说明光合作用产生的氧气来源于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
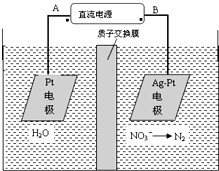 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.下列说法不正确的是( )
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.下列说法不正确的是( )| A、A为电源正极 |
| B、阳极反应式为:2H2O-4e-═4H++O2↑ |
| C、若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为10.4克 |
| D、阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.
某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t8 | 16.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-、Na+、SO42-、H+ |
| B、Cu2+、SO42-、H+、Cl- |
| C、K+、OH-、NO3-、HCO3- |
| D、Al3+、NO3-、SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com