
| A. | 卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| C. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| D. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
分析 A、卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高;
B、元素周期表共有18个纵行;
C、同主族元素的单质、化合物性质相似;
D、同主族元素的性质具有相似性和递变性.
解答 解:A、卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高,故A正确;
B、元素周期表共有18个纵行,故B错误;
C、卤族元素的单质从上到下颜色逐渐加深,则砹(At)为有色固体,卤族元素单质的卤化银都不溶于水也不溶于硝酸,故C正确;
D、碱金属元素从上到下元素的金属性逐渐增强,对应的单质与氧气反应的产物有氧化物、过氧化物、超氧化物等,越来越复杂,故D正确;
故选B.
点评 本题考查同主族元素的性质的相似性和递变性,题目难度不大,注意把握元素周期律的递变性和相似性.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$→_{v}^{O_{2}}$CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{结晶}{→}$CuSO4•5H2O | |
| B. | Al$→_{v}^{O_{2}}$Al2O3$\stackrel{{H}_{2}S{O}_{4}}{→}$Al2(SO4)3溶液$\stackrel{加热蒸干}{→}$Al2(SO4)3 | |
| C. | FeSO4溶液$\stackrel{{H}_{2}S}{→}$FeS$→_{干燥}^{过滤}$FeS晶体 | |
| D. | MgCl2溶液$→_{过滤}^{NH_{3}}$Mg(OH)2$\stackrel{适量HN{O}_{3}}{→}$Mg(NO3)2溶液$\stackrel{结晶}{→}$Mg(NO3)•6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的废水可以通过构成微生物电池除去,其原理如图所示.
)的废水可以通过构成微生物电池除去,其原理如图所示.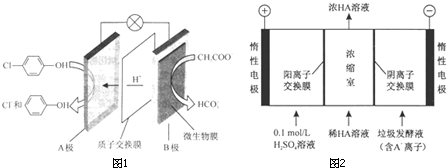
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的溴(KI溶液) | B. | 乙烷中的乙烯(酸性高锰酸钾) | ||
| C. | 乙酸乙酯中的乙酸(饱和Na2CO3溶液) | D. | 苯中的甲苯(Br2水) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g铜与足量稀硝酸反应过程中转移电子0.1NA | |
| B. | 35.5g超氧化钾(KO2)所含的阴离子的数目为NA | |
| C. | 标准状况下将0.5molSO2气体与0.5molH2S气体混合后,气体的分子总数为NA | |
| D. | 6g二氧化硅中含Si-O键数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷与NaOH水溶液混合加热后,经冷却,加入硝酸银溶液有淡黄色沉淀 | |
| B. | 淀粉在硫酸作用下水解得到葡萄糖,再加入新制银氨溶液并水浴加热,可得银镜 | |
| C. | 检验溴乙烷消去产物中的乙烯,可将反应逸出的气体直接通入酸性KMnO4溶液中 | |
| D. | 通过核磁共振氢谱的方法,可以检验出溴乙烷在NaOH水溶液中水解的产物有乙醇生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在AsCl5分子中,各原子最外层都达到了8电子稳定结构 | |
| B. | 砷的相对原子质量为74.92,由此可知砷原子核内有42个中子 | |
| C. | 砷的氢化物的化学式为AsH3,它是一种强氧化剂 | |
| D. | Na3AsO4溶液的pH大于7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com