
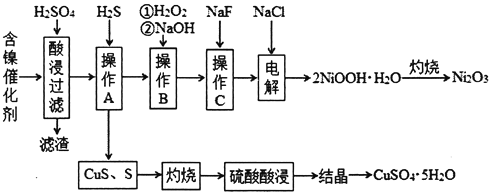
【题目】某科研小组以废旧的含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)为原料制取Ni2O3,工艺流程如下图:
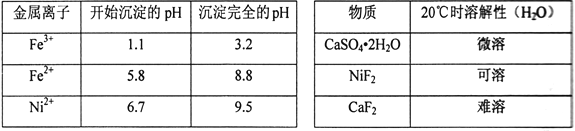
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
回答下列问题:
(1)滤渣的主要成分为BaSO4和____________________(填化学式)。
(2)操作A中发生反应的离子方程式为Cu2++H2S=CuS↓+2H+、_________________________;操作A中没有FeS和NiS沉淀产生,其原因是(用Ka和Ksp解释)__________________________。
(3)操作B加入H2O2的目的是________________,加NaOH溶液调节pH应在____________范围内;操作C中加入NaF的目的是____________________。
(4)该工艺流程中使用H2S气体,优点是可以制取副产品CuSO4·5H2O,但也有明显的缺点:一是产生空气污染,二是______________________________________________。
(5)电解产生2NiOOH·H2O的原理为:在碱性条件下电解,Cl-在阳极被氧化为ClO-,ClO-再将Ni2+氧化成2NiOOH·H2O沉淀。则阳极的电极反应式为________________________。
(6)0.80g CuSO4·5H2O副产品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,CuSO4·5H2O稳定存在的温度应低于________,则200℃时固体物质的化学式____________。

【答案】 CaSO42H2O 2Fe3++H2S=2Fe2++2H++S↓ 由Ka2=[S2-][H+]/[HS-]知:若溶液中c(H+)过大,则c(S2-)过小,达不到FeS和NiS沉淀的溶度积 将Fe2+氧化成Fe3+,有利于转化成Fe(OH)3沉淀 3.2≤pH<6.7 将Ca2+转化成CaF2沉淀 产生更多的Fe2+和H+,将消耗更多的氧化剂(H2O2)和NaOH Cl-+2OH--2e-=ClO-+H2O 102℃ CuSO4H2O
【解析】(1)由题目已知CaSO42H2O微溶,原料中含有一定量的CaO,加入硫酸酸浸,所以应该有CaSO42H2O析出。
(2)操作A的生成物中有单质S,只能是溶液中的Fe3+将通入的H2S氧化为单质S,方程式为:2Fe3++H2S=2Fe2++2H++S↓。注意:H2S是弱酸,不能拆分。上一步酸浸中硫酸应该过量,这一步通入H2S,H2S本来就是一个二元弱酸电离能力较差(Ka很小),上一步过量的氢离子对其电离又起到了抑制作用,所以溶液中的S2-的浓度应该很小。此时如果要形成硫化物沉淀,就要求该硫化物的KSP极小,本题中FeS和NiS的KSP较大,无法沉淀。
(3)加入过氧化氢的目的是为了将Fe2+氧化为Fe3+,以利于转化为氢氧化铁的沉淀除去。此时应该控制的pH是3.2到6.7之间(保证Fe3+沉淀完全,同时不沉淀Ni2+)。由题目已知,CaF2是难溶物,所以加入NaF是为了除去溶液中剩余的少量Ca2+。
(4)使用H2S气体,发生反应:2Fe3++H2S=2Fe2++2H++S↓,下一步中又要将Fe2+氧化为Fe3+,所以这个过程会增加需要加入的过氧化氢的量。同时反应生成H+会导致后续沉淀氢氧化铁的时候需要加入更多的氢氧化钠。
(5)阳极产生的是ClO-(ClO-再将Ni2+氧化成2NiOOH·H2O沉淀,是在溶液中进行的,不是电极反应),所以应该是Cl失去电子转化为ClO-,方程式为:Cl-+2OH--2e-=ClO-+H2O。
(6)图中102℃的时候固体质量开始下降,所以说明102℃时,CuSO4·5H2O开始分解,所以CuSO4·5H2O稳定存在的温度应低于102℃。图示中,200℃时,固体由0.8g降低为0.57g,减少0.23g。0.8gCuSO4·5H2O中含有的结晶水为0.288g,所以此时失去的都是结晶水,减少0.23g水,物质的量为0.0128mol,0.8gCuSO4·5H2O的物质的量为0.0032mol,其中含水为0.0032×5=0.016mol,所以200℃的时候剩余的结晶水为0.016-0.0128=0.0032mol,硫酸铜为0.0032mol,所以该化合物为:CuSO4H2O。


科目:高中化学 来源: 题型:
【题目】恒温下,在三个相同且恒容的容器中发生反应 2SO2(g)+O2(g)![]() 2SO3(g)△H=-196kJ/mol,有关数据如下:
2SO3(g)△H=-196kJ/mol,有关数据如下:
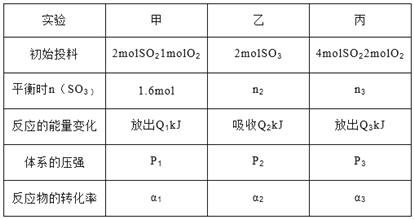
三个容器中反应分别达到平衡时下列数据关系正确的是( )
A. α1+α2= 1 且α3<α1 B. Q1+Q2=196 且 Q3>2Q1
C. n2<n3<3.2mol D. P3>2P1=2P2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选做-选修5: 有机化学基础】PET和PMMA是日常生活常见的两种高分子材料。下列是合成高分子材料的路线:

已知:①RCOOR1+R2OH![]() RCOOR2+R1OH
RCOOR2+R1OH
② (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)
回答下列问题:
(1)物质A的化学名称_______,物质H中官能团的名称________。
(2)由C生成D、I生成J的反应类型分别是_______、_______。
(3)由I生成J的反应中产生六元环的副产物,其结构简式为_______。
(4)写出D+乙二醇→F+G的化学反应方程式________________。
(5)D存在多种同分异构体,其中只含有一种官能团的三取代芳香族化合物且能与碳酸氢钠溶液作用产生气体的同分异构体有____种。
(6)写出用环己醇为原料制备 的合成路线(其他试剂任选)_________。
的合成路线(其他试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,A是固体金属单质,燃烧时火焰呈黄色。
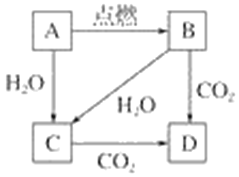
(1)写出下列符号所代表的物质的化学式:
A____________,B____________,C____________,D____________。
(2)写出下列转化的化学方程式:
①A→B________________________________________。
②B→D________________________________________。
③A→C________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼金属的方法错误的是( )
A.电解熔融NaCl制钠
B.加热HgO制汞
C.高温下用CO还原Fe2O3制铁
D.高温下用H2还原Al2O3制铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图所示实验,探究影响H2O2分解速率的因素。下列分析错误的是
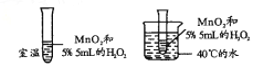
A. 该实验探究的是温度对反应速率的影响
B. 该实验要控制MnO2的质量、颗粒大小相同
C. 实验中,H2O2的浓度不宜过大
D. 温度相同时,若用FeCl3代替MnO2,反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧示意图和相关热化学反应如下:
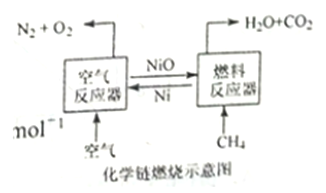
2Ni(s)+O2(g)=2NiO(s)△H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H=156.9 kJ·mol-1
下列说法错误的是( )
A. CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1
C. 甲烷在“燃料反应器”中反应时产生淡蓝色火焰并放出热量
D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,请计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和原溶液中溶质的物质的量浓度。
(3)在标准状况下生成H2的体积。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com