
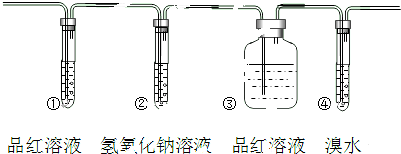
分析 实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,发生消去反应;根据二氧化硫和乙烯的性质的异同分析,二氧化硫为酸性气体,可与碱反应,可使品红褪色,具有还原性,可与溴水发生氧化还原反应,而乙烯含有碳碳双键,可与溴水发生加成反应,与酸性高锰酸钾发生氧化还原反应.
(1)①二氧化硫具有漂白性,通过品红检验二氧化硫的存在,②二氧化硫属于酸性氧化物,通过氢氧化钠溶液除去二氧化硫,③检验二氧化硫是否除尽;
(2)装置①中品红褪色,证明二氧化硫存在;
(3)二氧化硫与溴水发生氧化还原反应生成硫酸和溴化氢;
(4)乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性.
解答 解:利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(1)二氧化硫具有漂白性,装置①用来检验SO2,试管中品红溶液褪色,说明含有SO2,二氧化硫属于酸性氧化物,装置②试管装有NaOH溶液除去SO2,装置③试管通过品红溶液不褪色确认SO2已除干净,装置④通过溴水褪色检验乙烯,
故答案为:检验二氧化硫的存在;除去二氧化硫;检验二氧化硫是否除尽;
(2)二氧化硫具有漂白性,能够使品红褪色,若①中品红褪色,则能说明SO2气体存在,
故答案为:装置①中品红褪色;
(3)溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原反应生成硫酸和HBr,溶液中溴的颜色会褪去,反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:SO2+Br2+2H2O=H2SO4+2HBr;
(4)检验方法为:向反应后的溶液中滴加石蕊试液,溶液不变红,说明该反应为加成反应而非取代反应,乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性,
故答案为:乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性.
点评 本题考查了乙烯的实验室制法以及产物的检验,注意当有多种产物需检验时,应考虑先后顺序,注意乙烯的除杂和性质实验是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A. | PbO2是电池的负极 | B. | SO42-向Pb极移动 | ||
| C. | PbO2得电子,被氧化 | D. | 电池放电时,溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
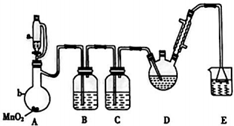 三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:| 物质 | C2H5OH | CCl3CHO | CCl3COOH | C6H5Cl |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,16g14CH4所含中子数数目为8NA | |
| C. | 15.6gNa2O2和水完全反应转移的电子数为0.2NA | |
| D. | 0.1L3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 | |
| B. | 1 mol H2SO4与1 molBa(OH)2反应时放出的热叫做中和热 | |
| C. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| D. | △H>0表示放热反应,△H<0 表示吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X可能是淀粉或纤维素 | B. | Y与CH3OCH3互为同分异构体 | ||
| C. | Z可能含有多个羧基 | D. | X中含有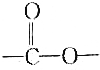 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物,都能发生水解反应 | |
| B. | 蔗糖和葡萄糖不是同分异构体,但属同系物 | |
| C. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| D. | 石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者都能水解,但水解的最终产物不同 | |
| B. | 二者都属于糖类,且都是高分子化合物 | |
| C. | 二者含C、H、O三种元素的质量分数相同,且二者互为同分异构体 | |
| D. | 二者的化学性质相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com