

| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| P>S | H->Li+ | KCl<Si | HClO3<HClO4 |
分析 (1)根据核外电子排布规律书写Cu原子的核外电子排布式,电子按能层高低进行失去,进而书写Cu2+的外围电子排布式;
乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4;
由图可知,Cu2+离子与N原子形成4个配位键;
(2)乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键;
(3)P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
电子层结构相同,核电荷数越大,离子半径越小;
原子晶体沸点高于离子晶体的熔沸点;
非羟基氧越多,含氧酸的酸性越强;
(4)A.a位置上Cl原子成2个单键(其中一个为配位键),含有2对孤对电子,杂化轨道数为4;
B.M的化学式为KCuCl3,其中铜元素为+2价,故化合物N中铜为+1价,阴离子构成与CuCl3一样,但CuCl3原子团的化合价为-2;
C.Cu、Al均采取sp3杂化;
金属铜单独与氨水或单独与过氧化氢都不能反应,而同时混合能反应,说明两者能互相促进,这是两种物质共同作用的结果:其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,根据电荷守恒知还有OH-生成;
(5)根据均摊法计算晶胞中Fe原子数目,进而计算晶胞质量,令Fe原子半径为r,对于体心立方堆积,体对角线上的原子相邻,则晶胞棱长为$\frac{4r}{\sqrt{3}}$,对于面心立方堆积,面对角线上的3个Fe原子相邻,则晶胞棱长为
4r×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r,据此计算晶胞体积,再根据ρ=$\frac{m}{V}$表示出晶体密度,进而计算密度之比.
解答 解:(1)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故Cu2+的外围电子排布式为3d9;
乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;
由图可知,Cu2+离子与N原子形成4个配位键,故配离子[Cu(En)2]2+中的配位数为4,
故答案为:3d9;sp3;4;
(2)乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高,
故答案为:乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(3)P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能P>S;
电子层结构相同,核电荷数越大,离子半径越小,故离子半径H->Li+;
KCl属于离子晶体,Si属于原子晶体,故熔点KCl<Si;
HClO3、HClO4非羟基氧数目分别为2、3,非羟基氧越多,含氧酸的酸性越强,故酸性HClO3<HClO4,
故答案为:>;>;<;<;
(4)A.a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,杂化轨道类型为:sp3,故错误;
B.M的化学式为KCuCl3,其中铜元素为+2价,故化合物N中铜为+1价,CuCl3原子团的化合价为-2,其化学式为:K2CuCl3,故正确;
C.配离子[CuCl4]2-和配离子[AlCl4]-配位数均为4,Cu、Al均采取sp3杂化,均为正四面体结构,故正确,
金属铜单独与氨水或单独与过氧化氢都不能反应,而同时混合能反应,说明两者能互相促进,这是两种物质共同作用的结果:其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,根据电荷守恒,还有氢氧根离子生成,反应离子方程式为:Cu+H2O2 +4NH3═Cu(NH3)42++2OH-,
故答案为:BC;Cu+H2O2 +4NH3═Cu(NH3)42++2OH-;
(5)令Fe原子半径为r,Fe原子摩尔质量为M,
对于体心立方堆积,体对角线上的原子相邻,则晶胞棱长为$\frac{4r}{\sqrt{3}}$,晶胞中含有Fe原子数目为1+8×$\frac{1}{8}$=2,则晶胞质量为$\frac{4M}{{N}_{A}}$,设晶胞密度为$\frac{\frac{2M}{{N}_{A}}}{(\frac{4r}{\sqrt{3}})^{3}}$,
对于面心立方堆积,面对角线上的3个Fe原子相邻,则晶胞棱长为4r×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r,晶胞中含有Fe原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为$\frac{4M}{{N}_{A}}$,设晶胞密度为$\frac{\frac{4M}{{N}_{A}}}{(2\sqrt{2}r)^{3}}$,
故ρ(a):ρ(b)=$\frac{\frac{2M}{{N}_{A}}}{(\frac{4r}{\sqrt{3}})^{3}}$:$\frac{\frac{4M}{{N}_{A}}}{(2\sqrt{2}r)^{3}}$=3$\sqrt{3}$:4$\sqrt{2}$,
故答案为:3$\sqrt{3}$:4$\sqrt{2}$.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、微粒构型、配合物、氢键、电离能、微粒半径比较、晶体类型与熔沸点、分子性质、晶胞计算等,比较全面的考查物质结构主干知识,需要学生具备扎实的基础、灵活运用知识的能力,(5)中计算为易错点、难点,对学生的空间想象与数学计算能力有较高的要求,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| B. | 用饱和氯化铵溶液可以清洗金属表面的锈迹 | |
| C. | “地沟油”禁止食用,但可用来制生物柴油和肥皂 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物,有固定的熔点?沸点 | |
| C. | 先通入氯气,再加入硫酸亚铁处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液或新制Cu(OH)2均能检验糖尿病人尿液中的葡萄糖 | |
| B. | 在燃煤中加入适量生石灰,可以减少二氧化硫的排放 | |
| C. | 铜制品在潮湿环境中的腐蚀比干燥环境中快 | |
| D. | 生活中的水杯、奶瓶、食物保鲜膜等可以使用聚氯乙烯来制造 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
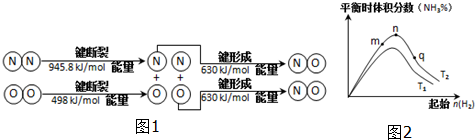
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若CO的燃烧热为△H3,则H2的燃烧热为△H3-△H1 | |
| B. | 反应CH4(g)+CO2(g)═2CO(g)+2H2(g)的△H=△H${\;}_{{\;}_{2}}$-△H1 | |
| C. | 若反应②的反应物总能量低于生成物总能量,则△H2<0 | |
| D. | 若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则△H1>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )| A. | 该反应的逆反应△H>0 | |
| B. | 增大反应物中CH3OCOOCH3的浓度能提高碳酸甲乙酯的平衡转化率 | |
| C. | 650℃,反应物配比为1:1时,平衡常数K=6 | |
| D. | 当C2H5OCOOC2H5与CH3OCOOC2H5生成速率比为1:2时,反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.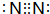 ,E属于元素周期表中ds区
,E属于元素周期表中ds区查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com