
25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是
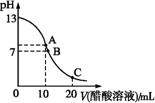 A. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
A. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.在B点:c(OH-)=c(H+),c(Na+)= c(CH3COO-))
C. 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.在C点: c(CH3COO-)+c(CH3COOH)=2c(Na+)
科目:高中化学 来源: 题型:
工业上可用硫酸铝与硫黄焙烧制备氧化铝:2Al2(SO4)3+3S  2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
A.反应中Al2(SO4)3被氧化
B.Al2O3是氧化产物
C.该反应中,每转移0.3 mol电子生成5.04 L SO2
D.氧化产物与还原产物的质量之比为1︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,将一定浓度的盐酸和一定浓度的氨水按2∶1 的体积比混合,若混合溶液中c(NH )=c(Cl-),则溶液的pH
)=c(Cl-),则溶液的pH
A.大于7 B.小于7 C.等于7 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
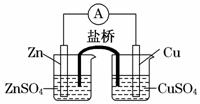
关于如图所示的原电池,下列说法正确的是
A.电子从铜电极通过检流计流向锌电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是 (填序号)。
A.明矾 B.二氧化氯 C.臭氧 D.高铁酸钠( Na2FeO4)
(2)高铁(VI)酸盐是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物氧化法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式: 。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式: 。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当有0.1molK2FeO4反应时,在电解池中生成H2 L(标准状况),同时生成Fe(OH)3= mol。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
| 含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
经处理后的废水pH=8,此时废水中Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17), (填“符合”或“不符合”)国家环保标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
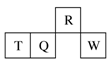
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
A.最简单气态氢化物的热稳定性:R>Q
B.原子半径:T>Q>R
C.最高价氧化物对应水化物的酸性:Q<W
D.含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是 ( )
A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,盐酸所加的水量多
B.盐酸和醋酸都可用相应的钠盐和浓硫酸反应制取
C.0.1mol·L-1醋酸钠溶液的pH>7
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:
3A(g)+2B(g) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com