
Ⅰ、一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0。
FeO(s)+CO(g) ΔH>0。
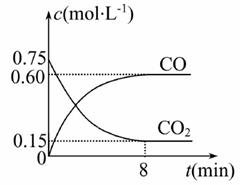
(1)下列措施中能使平衡时c(CO)/c(CO2)增大的是_________(填序号)。
A.升高温度 B.增大压强
C.充入一定量氮气 D.再加入一些铁粉
(2)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,使CO2的浓度成为原来的2倍,则CO2的转化率将_______(填“增大”“减小”或“不变”)。
Ⅱ、在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g),试分析和回答下列问题:
CO(g)+H2(g),试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是______(选填序号)。
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
(2)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其他条件不变),则容器内气体的平均相对分子质量将______(填写“不变”“变小”或“变大”)。
科目:高中化学 来源: 题型:
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g) CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
① 一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)

② 100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,反应达平衡的标志是: 。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4)= v逆(H2)如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为 。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH = 。(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是: 、 、能连续工作。
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,下列叙述中不正确的是
H++CH3COO-,下列叙述中不正确的是
( )
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种常见元素,只有W位于长周期。其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子的电子层数是最外层电子数的2倍 |
| Y | Y与X同周期,该元素与氧能形成多种化合物 |
| Z | Z的基态原子的最高能级上有2个单电子,其最高价氧化物对应的水化物是一种强酸 |
| W | W是一种过渡金属元素,在潮湿的空气中其表面会生成一种绿色的化合物 |
(1)X的最高价氧化物对应的水化物的化学式为__________________________,预测该化合物________(填“难”或“易”)溶于水。
(2)Z位于元素周期表第______周期第_____族;W元素的基态原子的核外电子排布式为________________________________________________________。
(3)Y和Z的氢化物中,前者较稳定,则共价键的键长较长的物质是__________(填化学式)。
(4)Y、Z和氢元素组成的某种含氧酸正盐溶液中,Z呈现最高正价。该物质的水溶液呈酸性,其原因是___________________(填离子方程式)。
(5)W2Z能与Y的最高价氧化物对应的水化物的稀溶液反应,生成物中无难溶物,写出反应的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一容积可变的容器里,反应2A(g) B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol、4 mol。在保持温度和压强不变的条件下,下列说法正确的是( )
B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol、4 mol。在保持温度和压强不变的条件下,下列说法正确的是( )
A.充入1 mol 稀有气体氦(He),平衡不移动
B.充入A、B、C各1 mol,平衡将向正反应方向移动
C.将A、B、C各物质的量都减半,C的百分含量不变
D.加入一定量的A气体达到平衡后,C的百分含量一定增加
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHSO4在水中的电离方程式为:NaHSO4====Na++H++S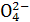 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是( )
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是( )
A.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性
B.水电离出来的c(H+)=1×10-10mol·L-1
C.c(H+)=c(OH-)+c(S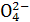 )
)
D.该温度高于25℃
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温下的六份溶液:
①0.01 mol·L-1CH3COOH溶液;
②0.01 mol·L-1HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (填序号,下同),水的电离程度相同的是 ;
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(填“>”“<”或“=”);
(3)将六份溶液同等稀释10倍后,溶液的pH:
① ②,③ ④,⑤ ⑥(填“>”“<”或“=”);
(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈 (填序号)。
A.酸性 B.碱性 C.中性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关等离子体的说法中,不正确的是( )
A.等离子体内部全部是带电荷的微粒
B.等离子体中正、负电荷大致相等
C.等离子体具有很好的导电性
D.等离子体用途十分广泛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com