
【题目】在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)![]() CO2(g)十H2 (g)十Q(Q>0),CO和H2O浓度变化如下图:
CO2(g)十H2 (g)十Q(Q>0),CO和H2O浓度变化如下图:
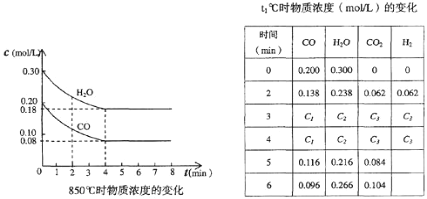
(1)则0~4 min的平均反应速率v(CO)=________mol/(L·min),该反应在850℃的平衡常数K=________
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min间,平衡向逆方向移动,可能的原因是_________(单选),表中5 min~6 min之间数值发生变化,可能的原因是_________(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
【答案】
(1)0.03;1
(2)①平衡;大于;②d;a
【解析】
试题分析:(1)①v(H2O)= ![]() =
=![]() =0.03mol/(Lmin),故答案为:0.03mol/(Lmin);
=0.03mol/(Lmin),故答案为:0.03mol/(Lmin);
②用三段式法计算:
CO(g) + H2O(g) ![]() CO2(g) + H2 (g)
CO2(g) + H2 (g)
起始:0.20mol/L 0.30mol/L 0 0
转化:0.12mol/L 0.12mol/L 0.12mol/L 0.12mol/L
平衡:0.08mol/L 0.18mol/L 0.12mol/L 0.12mol/L
则K=![]() =
=![]() =1,故答案为:1;
=1,故答案为:1;
(3)①根据温度对反应速率的影响可知,温度越高,反应速率越快,则反应达到平衡的时间越短,根据题意t1℃高于850℃,所以t1℃时反应先达到平衡,根据的(1)②可知850℃达到平衡时,c(CO)=0.08mol/L,由于是放热反应,温度升高,化学平衡向逆反应方向移动,C1数值应大于0.08 mol/L,故答案为:平衡;>;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,故选d.表中5min-6min之间CO浓度减少,H2O浓度增大,CO2浓度增大,只有增加水蒸气,使化学平衡向正反应方向移动,故选a,故答案为:d;a。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀毒消毒能力。常温常压下发生反应如下:反应①O3![]() O2+[O]△H>0 平衡常数为K1;反应②[O]+O3
O2+[O]△H>0 平衡常数为K1;反应②[O]+O3![]() 2O2△H<0 平衡常数为K2;总反应:2O3
2O2△H<0 平衡常数为K2;总反应:2O3![]() 3O2△H<0 平衡常数为K。下列叙述正确的是( )
3O2△H<0 平衡常数为K。下列叙述正确的是( )
A、升高温度,K增大 B、K=K1+K2
C、压强增大,K2减小 D、适当升温,可提高消毒效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是( )
A. 用10 mL量筒量取7.13 mL盐酸
B. 用广泛pH试纸测得某溶液的pH为2.3
C. 用25ml酸式滴定管量取21.70 mLKMnO4溶液
D. 用托盘天平称量25.20 g NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
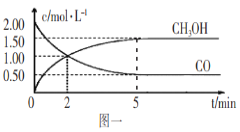
①从反应开始到l0min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=__________kJ/mol;
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从氧化还原的角度分析水在下列化学反应中只做还原剂的是_______________
A电解水 B钠和水的反应(2Na+2H2O===2NaOH+H2↑)
C氟气和水反应(2F2+2H2O===4HF+O2) D氯气和水反应(Cl2+H2O===HCl+HClO):
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是________;若反应方程式中转移了0.4 mol电子,则氧化产物的质量是_____ g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-,这个事实说明Fe2+、Cl-、Br—三种粒子还原性由强到弱的排列顺序为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或处理事故的方法正确的是( )
A. 用分液漏斗分离乙酸乙酯和水的混合物时,水从下口放出,乙酸乙酯从上口倒出
B. 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验
C. 用干燥的pH试纸测定NaClO溶液的pH
D. 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁与一定浓度的稀硝酸反应时,硝酸的还原产物为NH4NO3。现将一定量的镁粉投入200 ml 稀硝酸中,两者恰好完全反应。若向反应后的溶液中加入过量的浓NaOH溶液并微热,溶液中有白色沉淀生成,同时有氨气逸出,且逸出的氨气干燥后全部被稀硫酸吸收,稀硫酸增重0.17g 。试回答下列问题:
(1)根据上述信息写出Mg和硝酸反应的化学方程式:____________________。
(2)发生还原反应的硝酸的物质的量为________mol。
(3)参加反应的镁的质量为_________g。
(4)原稀硝酸的物质的量浓度为_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.1g镁铝合金溶于70ml4mol/L硫酸中,当合金完全溶解后,再加入70ml8mol/L的NaOH溶液,得沉淀的质量为13.6g,则加入硫酸时,产生H2的物质的量为
A. 0.2mol B. 0.25mol C. 0.3mol D. 0.35mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com