
| A. | ①④ | B. | ①⑤⑦⑧ | C. | ①⑤⑥ | D. | ⑤⑦ |
分析 纯净物是一种物质组成的物质,微观角度分析可知只含一种构成微粒,混合物是不同物质组成的物质,微观角度分析可知是不同微粒构成,据此分析.
解答 解:①水玻璃是硅酸钠的水溶液属于混合物,故①错误;
②水泥是硅酸三钙、硅酸二钙和铝酸三钙,属于混合物,故②错误;
③普通玻璃是硅酸钙、硅酸钠和二氧化硅的混合物,故③错误;
④漂白粉是氯化钙和次氯酸钙的混合物,故④错误;
⑤Na2CO3•10H2O是一种物质组成的为纯净物,故⑤正确;
⑥氯水是氯气的水溶液属于混合物,故⑥错误;
⑦液氯是氯气安置属于单质,是纯净物,故⑦正确;
⑧纯净的盐酸是氯化氢气体的水溶液属于混合物,故⑧错误;
故选D.
点评 本题考查了物质分类、物质组成、物质名称的分析应用,主要是常见物质的成分判断,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 将BaSO4放入水中不能导电,所以硫酸钡不是电解质 | |
| B. | NaCl溶液能导电,所以NaCl溶液是电解质 | |
| C. | 氯化氢溶于水能导电,但液态氯化氢不能导电 | |
| D. | 固态的NaCl不导电,熔融态NaCl可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量CO2通入溶液中:2NaCN+H2O+CO2=2HCN+Na2CO3 | |
| B. | 经测定CH3COONH4的水溶液呈中性可知:K(NH3•H2O)=1.75×10-5 | |
| C. | 将等物质的量浓度的CH3COONa与NaCN溶液等体积混合后的溶液中:c(CH3COO-)>c(CN-) | |
| D. | 常温下将10ml的PH=3的醋酸溶液稀释到100ml,其PH<4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
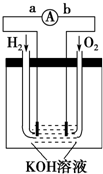 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮化硅陶瓷--导热剂 | B. | Si和Ge--半导体材料 | ||
| C. | 钢化玻璃--汽车窗玻璃 | D. | SiO2--制光纤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
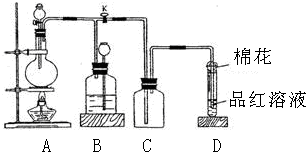
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com