
某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池组成正确的是( )
| 选项 | 正极 | 负极 | 电解质溶液 |
| A | Zn | Al | CuSO4 |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuCl2 |
| D | Cu | Zn | ZnCl2 |
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
I.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解
B.在250mL容量瓶中定容成250mL烧碱溶液
C.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞
D.将物质的量浓度为M mol/L的标准盐酸装入酸式滴定管,调整液面,记下开始刻度为V1 mL。
E.锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
回答下列问题:
(1)滴定达到终点的现象是 ;
(2)若酸式滴定管没有用标准盐酸润洗,会对测定结果有何影响 (填“偏高”“偏低”或“无影响”,其它操作均正确)
(3)该烧碱样品的纯度计算式是 。
II.(4)任何一个自发的氧化还原反应都可以设计成一个原电池。请根据:Fe+2Fe3+=3Fe2+,设计成一个原电池。该电池的正极材料为_____,其电极反应为__________________;电池中的电解质溶液可以选择 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应3Cl2+6KOH===5KCl+KClO3+3H2O中,得到电子的原子和失去电子的原子个数比是( )
A.5∶1 B.1∶5
C.1∶1 D.3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是( )
A.利用电池外壳的金属材料
B.回收其中石墨电极
C.防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D.不使电池中泄漏的电解液腐蚀其他物品
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中迅速制备少量氯气可利用如下反应:
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
此反应在常温下就可以迅速进行,而且对盐酸浓度要求不高。
(1)已知高锰酸钾和氯化锰都属于可溶性盐,请把上述化学方程式改写为离子方程式:________________________________________________________________________。
(2)该反应中,氧化剂是________,还原剂是________。当有1 mol氧化剂参加反应时,被氧化的还原剂的物质的量是________,产生的氯气在标准状况下的体积约为________。
(3)HCl在此反应过程中表现出的化学性质有________。
A.酸性 B.还原性
C.氧化性 D.挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应8NH3+3Cl2===6NH4Cl+N2,回答下列问题:
(1)氧化剂是________,还原剂是________。
(2)氧化剂与还原剂的分子个数比为_______________________________________。
(3)当有68 g NH3参加反应时,被氧化的物质为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO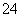 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
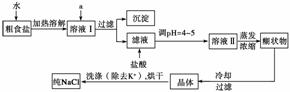
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO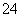 离子,选出a所代表的试剂,按滴加顺序依次为______________________(只填化学式)。
离子,选出a所代表的试剂,按滴加顺序依次为______________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,先用的试剂为__________。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外,还有__________(填仪器名称)。
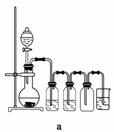
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4===ZnSO4+H2↑
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
据此,从下列所给仪器中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号)。
可选用制备气体的装置:

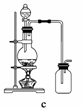
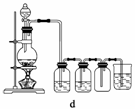
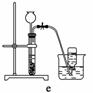
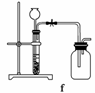
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com