
| A. | HA的pH=3;BOH的pH=13 | |
| B. | pH=a的HA溶液,稀释10倍,其pH=a+1 | |
| C. | 等体积的HA和BOH恰好完全反应,溶液的pH=7 | |
| D. | 相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同 |
分析 溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,Kw=c(H+)•c(OH-)=1×10-14,联立解得c(H+)=10-3mol/L,说明HA为弱酸;联立$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×1012、Kw=c(H+)•c(OH-)=1×10-14解得:c(OH-)=10-1mol/L,说明BOH为强电解质,
A.分别根据pH=-lgc(H+)计算出两溶液的pH;
B.0.1mol•L-1某一元酸(HA)溶液的pH=3,说明HA为弱酸,稀释后电离程度增大,则溶液的pH小于a+1;
C.HA为弱酸、BOH为强碱,二者反应生成强碱弱酸盐,溶液呈碱性;
D.HA为弱酸,盐酸为强酸,等pH等体积的HA和盐酸中,HA提供的氢离子的物质的量大于盐酸,产生的氢气HA大于盐酸.
解答 解:A.常温下,溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8、Kw=c(H+)•c(OH-)=1×10-14,联立解得c(H+)=10-3mol/L,该溶液的pH=3;联立$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×1012、Kw=c(H+)•c(OH-)=1×10-14解得:c(OH-)=10-1mol/L,该溶液的pH=13,故A正确;
B.根据A可知.0.1mol•L-1某一元酸(HA)溶液的pH=3,说明HA为弱酸,稀释后电离程度增大,溶液中氢离子浓度增大,则溶液的pH小于a+1,故B错误;
C.0.1mol•L-1的BOH溶液的pH=13,说明BOH为强电解质,两溶液等体积混合后生成强碱弱酸盐,溶液显示碱性,故C错误;
D.HA为弱酸,在溶液中只能部分电离出氢离子,pH相等的HA和盐酸中,HA的物质的量浓度大于盐酸,则相同体积相同pH的HA和盐酸分别与足量Zn反应,HA产生的氢气多,故D错误;
故选A.
点评 本题考查了弱电解质的电离平衡及其影响、溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握弱电解质的电离平衡及其影响因素,试题侧重考查学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 在上述五种元素形成的单质中,X元素可形成几种同素异形体 | |
| C. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定没有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| AgCl | Agl | Ag2S | |
| KSP(单位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化为溶解度更小的沉淀 | |
| C. | AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶解度相同 | |
| D. | 25℃时,在饱和AgCl、Agl、Ag2S溶液中,所含Ag+的浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 组成单质的分子内一定含有共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- | |
| B. | 向1 mo1•L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| C. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001 mol•L-1,c(CO32-)=0.0001 mol•L-1,此时Mg2+和CO32-不能共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
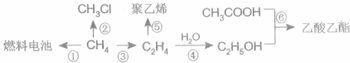
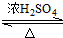 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在地壳中,C元素的含量位于第一位 | |
| B. | 由B、C、D三种元素组成的盐只有两种 | |
| C. | C元素位于元素周期表中的第3周期第ⅠA族 | |
| D. | B元素与氢元素形成化合物的化学式一定为H2B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀盐酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4NCO3溶于过量的NaOH溶液中:HCO3-+OH+═CO32-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O→C6H5OH+CO32- | |
| D. | 往氨水中滴加氢氧化钠溶液:OH-+H+═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com