
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
【答案】A
【解析】
根据短周期元素X、Y、Z、W、Q在元素周期表中的相对位置可知,它们分别是N、O、Al、S、Cl,据此分析解答。
A.根据以上分析,X、Y、Z、W、Q分别是N、O、Al、S、Cl,N元素最高正化合价为其主族数等于5,Al元素最高正化合价为其主族数等于3,二者之和等于8,故A正确;
B. 同周期自左向右原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,所以原子半径的大小顺序为rZ>rW>rQ>rX>rY,故B错误;
C.离子Y2-和Z 3+都为10微粒,核外电子数和电子层数都相同,故C错误;
D. 同周期自左向右非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,故D错误。
答案选A。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、CO32-、S2-、SO32-、AlO2-、Cl-、SO42-中的一种或几种,对该溶液进行实验,结果如图:

下列说法不正确的是( )
A. 淡黄色沉淀甲为AgBr,沉淀乙为Al(OH)3
B. 溶液中一定含有Na+、S2-、SO32-、AlO2-
C. 气体甲的成分可能是CO2或SO2或H2S或CO2、SO2的混合气体或CO2、H2S的混合气体
D. 确定溶液A中是否含有SO42-,可在沉淀丙中加入足量稀盐酸,若沉淀部分溶解则溶液A中含有SO42-,若沉淀全部溶解则溶液A中不含SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应可表示为

下列说法不正确的是
A. 若A、B都是短周期元素,则B的原子序数可能是A的两倍
B. 若乙是一种常见的半导体材料,则通过该反应说明A的非金属性一定比B强
C. 若A、B均为非金属元素,则该反应过程中可能会产生白烟
D. 该反应可用于某些金属的冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。已知WO3和LiFe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色。下列有关说法不正确的是

A. 当外电流通过1mol电子时,通过离子导体层的Li+数目为NA
B. 为了获得较好的遮光效果,A应该接电源的负极
C. 该电致变色系统在较长时间的使用过程中离子导体层中Li+的量可保持基本不变
D. 当B接电源正极时,离子储存层反应为:Fe4[Fe(CN)6]3+4Li++4e-= Li4Fe4[Fe(CN)6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢,________与盐酸反应产生的气体最多。钾、镁两种金属最高价氧化物对应水化物碱性从强到弱的顺序是________,最高价氧化物对应水化物呈两性的是__________(填化学式)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为______________________。
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律:

(3)仪器B的名称为___________,干燥管D的作用为_______________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____________的现象,即可证明,从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液_____________吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气除去 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+B![]() C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是
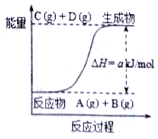
A. 产物C的能量高于反应物的总能量
B. 若该反应中有电子得失,则可设计成原电池
C. 反应物的总能量低于生成物的总能量
D. 该反应中的反应物A和B的转化率定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Hln在水溶液中存在电离平衡:HIn(红色)H++In-(黄色),故可用做酸碱指示剂。下列稀溶液中能使指示剂由黄色变为红色的是
A.盐酸B.氢氧化钠溶液C.食盐溶液D.氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com