
下列除杂(括号内为少量杂质)所用方法合理的是
A.FeCl3溶液(CuCl2):铁粉,过滤
B.NaBr溶液(NaI):溴水,萃取分液
C.苯(苯酚):NaOH溶液,蒸馏
D.氯化氢(氯气):饱和食盐水,洗气
B
【解析】
试题分析:A.由于氧化性:FeCl3 >CuCl2,所以若向FeCl3溶液中加入过量的铁粉,所有物质都反应而变质,错误;B.若NaBr溶液含有杂质NaI,加入溴水,发生反应:Br2+2NaI=NaBr+I2. I2容易溶于有机物,而在水中溶解度不大,利用这一性质及水与有机物互不相溶的性质,再萃取分液就得到纯净的NaBr溶液,正确;C.若苯中含有杂质苯酚,加入NaOH溶液,发生反应产生可溶于水的物质——苯酚钠,苯不溶于水,二者分层,再分液得到净化,错误;D.由于氯化氢极容易溶于水,所以不能用排饱和食盐水的方法通过洗气净化,错误。
考点:考查物质的净化试剂、除杂方法的正误判断的知识。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:填空题
(本题共12分)氨是一种重要的化工产品。“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
完成下列填空:
23.恒温恒容条件下,能说明该反应达到平衡状态的是 (填字母序号)。
a.ν(CO)消耗 = ν(H2O)生成 b.c(CO2) = c(CO)
c.混合气体的总压不再改变 d.混合气体的密度不再改变
24.将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | CO2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 650 | 2 | 1 | A | B | t |
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为 。
②A = 。
③平衡常数:K(900℃) K(650℃) (填“>”、“<”或“=”=)。
25.温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是 。
26.C、H、O、N元素中,核外电子占据5个不同轨道的原子,其最外层电子排布式是 。这四种元素形成的化合物 (填“一定是”、“一定不是”、“不一定是”)离子化合物。
27.能证明碳的非金属性比硅强的事实是 (选填编号)。
a.酸性:H2CO3强于H2SiO3 b.高温下SiO2与C生成Si和CO
c.键的极性:C-H > Si-H d.熔点:金刚石 > 单晶硅
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是 ;
24.碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是 ;液溴的保存通常采取的方法是 。
26.通过比较___________或________________可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体:

①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O 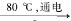 □NaClO3 + □
□NaClO3 + □
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
根据右表,以下错误的是
酸 | HF | H3PO4 |
电离常数 | Ki = 3.6×10 - 4 | Ki1= 7.5×10 -3 Ki2= 6.2×10 -8 Ki3= 2.2×10 -13 |
A.NaF和H3PO4反应的产物只有HF、NaH2PO4
B.0.10 mol/L的溶液,pH由大到小的顺序是Na3PO4>Na2HPO4>NaF>NaH2PO4
C.0.10 mol/L的H3PO4溶液中,0.30 mol/L>c(H+)>0.10 mol/L
D.25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列实验过程中,始终无明显现象的是
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入Ba(NO3)2溶液中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:填空题
(本题共12分)
某酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):

49.A→B的反应类型是________,B→C为加成反应,则化合物M的结构简式是____________;
50.H中除了羰基(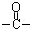 )外,含有的官能团名称是_______________;
)外,含有的官能团名称是_______________;
51.E→ F的化学方程式是__________________________________;
52.TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱表明,分子中除苯环外,其它氢原子化学环境相同;②存在甲氧基(CH3O—)。TMOB的结构简式是_______________;
53.下列说法正确的是
A.D和F中均属于炔烃类物质
B.A能和HCl反应得到聚氯乙烯的单体
C.1mol G完全燃烧生成7mol H2O
D.H能发生加成、取代反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
下列有关金属腐蚀的推断正确的是
A.金属腐蚀就是金属原子失去电子被还原的过程
B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH-
C.1.68g铁粉发生吸氧腐蚀时,理论上最多能吸收氧气504mL(标准状况)
D.镀锌铁皮的镀层损坏后,铁更容易腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
已知A、B为单质,C为化合物。且有如下转化关系

①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液与Na2CO3溶液反应,放出CO2气体,则A可能是H2
③若C溶液中滴加NaOH溶液,先生成沉淀后又溶解,则B可能为Al
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
能实现上述转化关系的是
A.①② B.②④ C.①③ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com