
| m |
| M |
| 100g |
| 32g/mol |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:
| A、NH4+ |
| B、NO |
| C、NO2 |
| D、N2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、颜色 |
| B、密度 |
| C、N2O4的浓度 |
| D、压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、特氟隆(聚四氟乙烯)的单体是氟利昂(CCl2F2) |
| B、蛋白质是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔现象 |
| C、附近人员应迅速远离液氯泄漏地点,并顺风方向疏散 |
| D、AgI和干冰都可用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
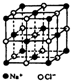 【化学--进修3:物质结构与性质】
【化学--进修3:物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com