
【题目】将FeCl3溶液和KI溶液混合,发生反应:2Fe3+(aq)+2I-(aq)![]() 2Fe2+(aq)+I2(aq)。下列各项能判断上述可逆反应达到平衡状态的是
2Fe2+(aq)+I2(aq)。下列各项能判断上述可逆反应达到平衡状态的是
A. 溶液颜色不再变化
B. c(K+)不再变化
C. c(Fe3+)与c(Fe2+)之和不再变化
D. v正(I-)=2v正(I2)
【答案】A
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
A项,溶液颜色不再变化,说明Fe3+、Fe2+及I2的浓度不再变化,反应达到平衡状态;B项,钾离子浓度始终不变,因此c(K+)不变不能用于判断反应是否达到平衡状态;C项,由铁元素守恒知,铁离子和亚铁离子的浓度之和始终不变,因此c(Fe3+)与c(Fe2+)之和不变不能用于判断反应是否达到平衡状态;D项,v正(I-)和v正(I2)同为正反应速率,v正(I-)=2v正(I2)不能用于判断反应是否达到平衡状态。
故选A。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】B、N、Ti、Fe都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态Fe2+的电子排布式为_____;Ti原子核外共有________种运动状态不同的电子。
(2)BH3分子与NH3分子的空间结构分别为_________;BH3与NH3反应生成的BH3·NH3分子中含有的化学键类型有_______,在BH3·NH3中B原子的杂化方式为________。
(3)N和P同主族。科学家目前合成了N4分子,该分子中N—N—N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途___________。(写出一种即可)
(4)NH3与Cu2+可形成[Cu(NH3)4]2+配离子。已知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是____。
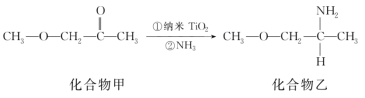
(5)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物乙的沸点明显高于化合物甲,主要原因是______。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 羟基与氢氧根离子有相同的化学式和电子式
B. 乙醇的官能团是—OH,可与NaOH溶液发生中和反应
C. 常温下,1 mol乙醇可与足量的Na反应生成11.2 L H2
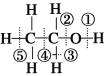
D. 已知乙醇的结构式如图所示,则乙醇催化氧化时断裂的化学键为①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示。则下列有关说法中不正确的是
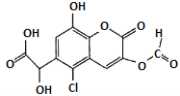
A. 能发生加成、取代、氧化反应B. 能与FeC13溶液发生显色反应
C. 1mol该物质最多可与6molH2反应D. 1mol该物质最多可与7molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:
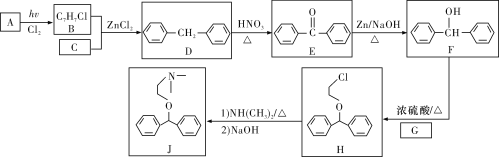
已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是___,H中的官能团名称是_______。
(2)由E生成F的反应类型是______,G的结构简式为______。
(3)A→B的化学方程式为_____。
(4)L是F的同分异构体,含有联苯(![]() )结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为_____。
)结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为_____。
(5)写出用氯乙烷和2-氯-1-丙醇为原料制备化合物![]() 的合成路线(其他无机试剂任选)。____
的合成路线(其他无机试剂任选)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可采用湿法技术从废印刷电路板中回收纯铜,其流程简图如下:
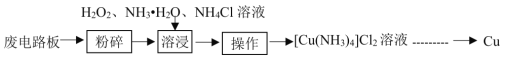
回答下列问题:
(1)开始时,将废电路板“粉碎”的目的是__________。“操作”的名称是_________________。
(2)某化学兴趣小组同学为探究“溶浸”过程中反应的实质,采用如图所示的装置,设计了如下对照实验。
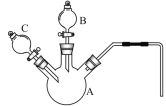
序号 | 实验名称 | 实验步骤 | 实验现象 | |
Ⅰ | 将铜片置于H2O2溶液中 | 先向A中加入0.5g光亮的铜片,再通过B加入30%的H2O2溶液 | —————— | 开始无明显现象,10小时后,溶液变为浅蓝色,铜表面附着一层蓝色固体 |
Ⅱ | 将铜片置于硫酸酸化的H2O2溶液中 | 再通过C加入8mL 5mol/L 的稀硫酸 | 开始铜片表面产生少量气泡,随着反应的进行,气泡越来越多,溶液颜色为蓝色,铜片表面保持光亮 | |
Ⅲ | 将铜片置于有氨水的H2O2溶液中 | 再快速通过C加入8mL 5mol/L的氨水 | 立即产生大量的气泡,溶液颜色变为深蓝色,铜片表面有一层蓝色固体附着,产生的气体能使带火星的木条复燃 | |
Ⅳ | 将铜片置于加有氨水和NH4Cl的H2O2溶液中 | 先向A中加入0.5g光亮的铜片和0.2g NH4Cl固体,再通过B加入30%的H2O2溶液 | 再快速通过C加入8mL 5mol/L的氨水 | 立即产生大量的气泡,______,铜片表面依然保持光亮 |
①仪器A的名称为______________________。
②实验Ⅰ中反应的化学方程式为___________________________。
③实验Ⅱ中产生的气体是________(写化学式),实验Ⅱ比实验Ⅰ/span>现象明显的原因是__________。
④实验Ⅲ中“溶液颜色变为深蓝色”所发生反应的离子方程式为________________。
⑤实验Ⅳ中空格处实验现象为__________,加入NH4Cl的作用是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物R是合成某药物的中间体,结构简式为![]() 。下列说法正确的是
。下列说法正确的是
A.R与M(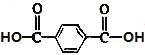 )互为同分异构体B.R中所有碳原子一定处于同一平面
)互为同分异构体B.R中所有碳原子一定处于同一平面
C.R的六元环上的一氯代物有4种D.R能发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、
夹持装置未画出、![]() 固体易升华
固体易升华![]() 的说法正确的是
的说法正确的是

A. 加热时,![]() 中封管内固体消失
中封管内固体消失
B. 加热时,![]() 中溶液变红,冷却后又变为无色
中溶液变红,冷却后又变为无色
C. 加热时,![]() 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现![]() 的漂白性
的漂白性
D. 加热又冷却的过程中,![]() 属于物理变化,
属于物理变化,![]() 属于化学变化
属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。乙烯是石油化工最重要的基础原料,请根据以下框图回答:
![]()
(1)乙烯分子的空间结构为__;C官能团名称是___。
(2)与乙烯和氢气的加成产物互为同系物的是__(填写编号)。
a.C2H2 b.C6H6 c.C5H12 d.C2H6O
(3)A→B的化学方程式__。
(4)A+C→乙酸乙酯的化学方程式__;在该反应中,在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放__,其目的是__;实验室常用饱和碳酸钠溶液来收集乙酸乙酯其作用为__。
(5)“乙烯→A”的反应类型是___反应。下列物质在一定条件下都能与乙烯反应,其中反应类型与“乙烯→A”的不相同的是__(填序号)。
①氢气 ②氯化氢 ③氧气 ④溴水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com