
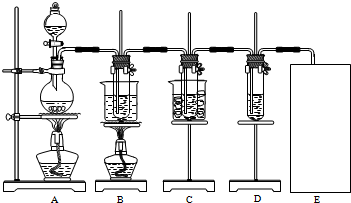
分析 (1)装置图分析可知,制备氯气的原理是利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,浓盐酸从分液漏斗中加入;
(2)氯气与氢氧化钾在加热条件下生成氯化钾和氯酸钾和水;氯气中可能含有氯化氢气体,AB间增加一个洗气装置,盛饱和食盐水的洗气瓶吸收氯化氢,避免产生误差;
(3)氯气与水反应生成盐酸和次氯酸,既有酸性,又具有漂白性;
(4)E为尾气吸收装置需要氢氧化钠溶液吸收多余的氯气,据此画出装置图;
(5)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性;
解答 解:(1)制备氯气的原理是利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,浓盐酸从分液漏斗中加入,反应的化学方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:分液漏斗;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)氯气与氢氧化钾在加热条件下生成氯化钾和氯酸钾和水,化学方程式:3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O;氯气中可能含有氯化氢气体,AB间增加一个洗气装置,盛饱和食盐水的洗气瓶吸收氯化氢,避免产生误差,
故答案为:3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O;在装置A、B之间加一个盛饱和食盐水的洗气瓶;
(3)氯气与水反应生成盐酸和次氯酸,既有酸性,又具有漂白性,能够使石蕊先变红色后褪色,
故答案为:溶液先变红后褪色;
(4)剩余的氯气不能排放到空气中,需要用氢氧化钠溶液吸收,装置图为 ,故答案为:
,故答案为: ;
;
(5)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性,化学方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
点评 本题考查了氯气的制备及性质,掌握并熟练应用氯气的有关化学反应原理是解题关键,注意氯气与氢氧化钠溶液反应条件不同得到产物不同,题目难度中等.


科目:高中化学 来源: 题型:解答题
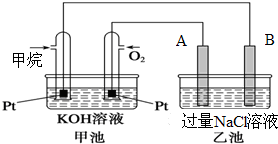 如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题:
如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| B | 将SO2和CO2气体分别通入水中至饱和,立即用pH计测两溶液的pH | 前者的pH小于后者 | H2SO3酸性强于H2CO3 |
| C | 铝热剂溶于足量稀盐酸再滴加KSCN溶液 | 未出现血红色 | 铝热剂中不能确定是否含有铁的氧化物 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入几滴新制Cu(OH)2悬浊液,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Zn | Fe | 碳棒 | Cu |
| 负极 | 碳棒 | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碱式滴定管取23.10mL溴水 | |
| B. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| C. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
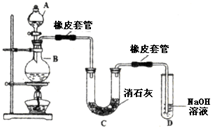 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 5.6g | C. | 2.8g | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com