
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| B | B原子最外层电子数是次外层的两倍 |
| C | C元素在空气中含量最多 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与B同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
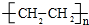 .
. ;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.分析 短周期元素中,A的原子半径最小,则A为H元素;B原子最外层电子数是次外层的两倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;C元素在空气中含量最多,则C为N元素;D是短周期中金属性最强的元素,则D为Na;E的最高价氧化物对应水化物是一种常见的两性氢氧化物,则E为Al;R与B(碳)同主族,则R为Si;T的负一价阴离子的核外电子排布与Ar原子相同,则T为Cl.
解答 解:短周期元素中,A的原子半径最小,则A为H元素;B原子最外层电子数是次外层的两倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;C元素在空气中含量最多,则C为N元素;D是短周期中金属性最强的元素,则D为Na;E的最高价氧化物对应水化物是一种常见的两性氢氧化物,则E为Al;R与B(碳)同主族,则R为Si;T的负一价阴离子的核外电子排布与Ar原子相同,则T为Cl.
(1)R为Si元素,在周期表的位置是:第三周期IVA族,化合物DT为NaCl,存在的化学键是离子键,
故答案为:第三周期IVA族;离子键;
(2)Al与NaOH溶液反应的离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(3)1mol气态C2H4在适量O2中燃烧生成CO2和液态H2O,放出热量为akJ×$\frac{1mol×28g/mol}{1g}$=28a kJ,反应热化学方程式为:C2H4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-28a kJ/mol,
C2H4发生加聚反应生成聚乙烯,反应化学方程式为:n C2H4$\stackrel{一定条件}{→}$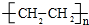 ,
,
故答案为:C2H4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-28a kJ/mol;n C2H4$\stackrel{一定条件}{→}$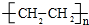 ;
;
(4)SiCl4极易水解生成两种酸,该反应的化学方程式:SiCl4+4H2O=H4SiO4↓+4HCl,
故答案为:SiCl4+4H2O=H4SiO4↓+4HCl;
(5)工业上用A元素的单质、C元素的单质合成化合物,反应方程式为:N2(g)+3H2(g)?2NH3(g),此反应的平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}(N{H}_{3})}$,为了提高合成效率,常采用的方法有:采取高温高压、使用催化剂等,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}(N{H}_{3})}$;采取高温高压、使用催化剂;
(6)D的过氧化物为Na2O2,电子式为 ,它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑
,它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑
故答案为: ;2Na2O2+2H2O=4NaOH+O2↑;
;2Na2O2+2H2O=4NaOH+O2↑;
(7)工业上电解饱和NaCl水溶液的离子方程式为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
点评 本题考查结构性质位置关系、元素化合物知识、热化学方程书写、化学平衡常数、电解原理等内容,侧重对化学用语的考查,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有③ | B. | ②③ | C. | ③⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ①②⑤ | C. | ③④⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应 | 反应物 | 氧化产物和还原产物 |
| 反应① | Cl2、FeI2 | FeCl3、FeCl2、I2 |
| 反应② | MnO4-、Cl- | Cl2、Mn2+ |
| A. | 反应①中Cl2与 FeI2的物质的量之比为2:1 | |
| B. | 反应①中发生的离子方程式可能为:2Cl2+2Fe2++2I-→I2+2Fe3++4Cl- | |
| C. | 反应②中每生成1molCl2,电子转移数目为10mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,失去电子的物质所含元素化合价降低 | |
| B. | 在一个氧化还原反应中,氧化剂和还原剂不可能是同一物质 | |
| C. | 氧化还原反应的本质是电子的转移(得失或偏移) | |
| D. | 在氧化还原反应中所有元素的化合价一定都发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷是烃类物质中氢的质量分数最高的化合物 | |
| C. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 | |
| D. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该过程是化学能转化为电能的过程 | |
| B. | 一段时间后,①池中n(KHCO3)不变 | |
| C. | 一段时间后,②池中溶液的pH一定增大 | |
| D. | 铜电极的电极反应式为:CO2+6H2O+8e-═CH4+8 OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,热化学方程式是 2H2(g)+O2(g)═2H2O(l)△H=-484kJ•mol-1 | |
| B. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol | |
| C. | 1 g丙烷(C3H8)完成燃烧生成CO2气体和液态水,放出50.405 kJ热量C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 217.82 kJ/mol | |
| D. | 1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2═SO2△H=-297.3 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com