
| 100mL |
| 25mL |
| 90 |
| 90+18x |
| 0.9c(b-a)g |
| mg |
| 50m |
| 9c?(b-a) |
| 50m |
| 9c?(b-a) |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
| A、1.12L | B、2.24L |
| C、3.36L | D、都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物:盐酸、生铁、空气 |
| B、化合物:CaCl2、NaOH、HCl |
| C、碱:苛性钠、纯碱、氢氧化钾 |
| D、单质:Ca、O3、石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
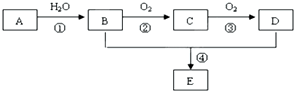
查看答案和解析>>
科目:高中化学 来源: 题型:
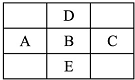 如图是周期表的一部分,A、B、C、D、E五种元素的原子核共含有80个质子.
如图是周期表的一部分,A、B、C、D、E五种元素的原子核共含有80个质子.查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.| A-B | A═B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com