
 水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:
水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:| 相对分子 质量 | 沸点/℃: | 在水中的溶解性 | |
| 甲醇 | 32 | 64.7 | 与水以任何比例相溶 |
| 水杨酸 | 138 | 211 | 0.22g/100ml |
| 水杨酸甲酯 | 152 | 222 | 0.07g/100ml |
 +CH3OH$\stackrel{H+}{?}$
+CH3OH$\stackrel{H+}{?}$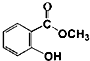 +H2O
+H2O分析 (1)蒸馏时,三颈瓶内盛放溶液体积为三颈瓶容积的$\frac{1}{3}$~$\frac{2}{3}$;
(2)球形冷凝管能冷凝回流蒸出的馏分;
(3)根据图知,用到的仪器为分液漏斗、锥形瓶;
(4)一种反应物过量时能促进另一种反应物的转化;
(5)第一次水洗是洗涤甲醇、硫酸,碳酸钠溶液洗涤是洗涤硫酸,第二次水洗是洗涤过量的碳酸钠溶液,碳酸钠溶液呈碱性,能促进酯类水解,且碳酸钠能和氯化钙发生复分解反应生成难溶性固体;
(6)n(水杨酸)=$\frac{7.0g}{138g/mol}$=0.05mol,根据 +CH3OH$\stackrel{H+}{?}$
+CH3OH$\stackrel{H+}{?}$ +H2O
+H2O
知,如果水杨酸完全反应则需要甲醇的物质的量为0.05mol,实际上甲醇的物质的量是0.64mol,则甲醇过量,生成的水杨酸甲酯的物质的量为0.05mol,水杨酸甲酯的质量=0.05mol×152g/mol=7.7g,
则水杨酸甲酯的产率=$\frac{实际质量}{理论质量}×100%$;
(7)该反应中浓硫酸体现吸水性和催化性.
解答 解:(1)蒸馏时,三颈瓶内盛放溶液体积为三颈瓶容积的$\frac{1}{3}$~$\frac{2}{3}$,假设水杨酸的密度按1g/mL计算,则三颈瓶中溶液体积=(7+30+3)mL=40mL,如果溶液体积占$\frac{1}{3}$,三颈瓶容积为120mL,如果溶液体积占$\frac{2}{3}$,则三颈瓶容积为60mL,实际上在二者之间,所以应该是100mL,故选A;
(2)球形冷凝管能冷凝回流蒸出的馏分,且甲醇有毒,用球形冷凝管能回收甲醇,减少甲醇的逸出,
故答案为:甲醇有毒,用于回收甲醇;
(3)根据图知,用到的仪器为分液漏斗、锥形瓶,故答案为:分液漏斗、锥形瓶;
(4)一种反应物过量时能促进另一种反应物的转化,所以甲醇过量时能促进水杨酸的转化率,
故答案为:提高水杨酸的转化率;
(5)第一次水洗是洗涤甲醇、硫酸,碳酸钠溶液洗涤是洗涤硫酸,第二次水洗是洗涤过量的碳酸钠溶液,碳酸钠溶液呈碱性,能促进酯类水解,且碳酸钠能和氯化钙发生复分解反应生成难溶性固体,所以如果没有第二次水洗会导致溶液中含有碳酸钠,溶液呈碱性,导致促进水杨酸甲酯水解,且和氯化钙生成的碳酸钙沉淀堵塞分液漏斗,
故答案为:残留的碳酸钠与CaCl2反应生成沉淀堵塞分液漏斗,并在蒸馏时会促进水杨酸甲酯的水解
;
(6)n(水杨酸)=$\frac{7.0g}{138g/mol}$=0.05mol,根据 +CH3OH$\stackrel{H+}{?}$
+CH3OH$\stackrel{H+}{?}$ +H2O
+H2O
知,如果水杨酸完全反应则需要甲醇的物质的量为0.05mol,实际上甲醇的物质的量是0.64mol,则甲醇过量,生成的水杨酸甲酯的物质的量为0.05mol,水杨酸甲酯的质量=0.05mol×152g/mol=7.7g,
则水杨酸甲酯的产率=$\frac{实际质量}{理论质量}×100%$=$\frac{6.1g}{7.7g}×100%$=79.2%,故答案为:79.2%;
(7)浓硫酸能吸水,该反应中生成水被浓硫酸吸收,从而促进平衡正向移动,且浓硫酸能作该反应的催化剂,所以该反应中浓硫酸体现吸水性和催化性,
故答案为:催化、吸水.
点评 本题考查有机物制备,为高频考点,涉及仪器选取、实验基本操作、化学方程式有关计算等知识点,明确常见仪器的名称及用途、基本操作规范性及基本计算方法是解本题关键,易错点是(1)中仪器的选取,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
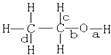
| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和浓硫酸共热至170℃时键b和d断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和氢溴酸反应键a断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯中少量的苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 | |
| B. | 将苯酚晶体放入少量水中,加热时全部溶解,冷却到50℃形成悬浊液 | |
| C. | 苯酚的酸性很弱,不能使指示剂变色,但可以和NaHCO3反应放出CO2 | |
| D. | 苯酚也可以与硝酸发生硝化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| B. | 将80 g SO3溶于水并配成1 L溶液,溶质的物质的量浓度为1 mol•L-1 | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 1 mol•L-1 NaCl溶液含有NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
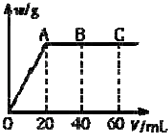 有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).
有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 补血剂中铁元素的化合价为+2价 | |
| B. | 铝是人体中的一种微量元素,如果摄入量过多,易患老年痴呆症 | |
| C. | 铝能溶解于氢氧化钠溶液中,而铁不能与氢氧化钠溶液反应 | |
| D. | 铝的导热性比铁强,因而用铝锅煮食物比铁锅好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32- | |
| B. | 将SO2通入含HClO的溶液中生成H2SO4,说明酸性:HClO>H2SO4 | |
| C. | 浓、稀硝酸与Cu反应的产物分别是NO2和NO,说明氧化性:稀硝酸>浓硝酸 | |
| D. | 高温时C能置换出SiO2中的Si,说明还原性:C>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com