
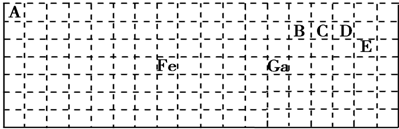

分析 (1)Ga位于第四周期第IIIA族,最外层有3个电子;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的;Fe为26号元素,原子核外电子数为26;
(3)价电子数相同和原子数相同的微粒互称等电子体;
(4)价层电子对数=σ键电子对数+中心原子上的孤电子对数,根据价层电子对数判断微粒构型;根据元素周期表知,B、C、D、E分别是C、N、O、Cl是四种元素,若化合价的绝对值+原子最外层电子数=8,分子中每个原子最外层都达到8电子稳定结构,据此分析.
解答 解:(1)Ga位于第四周期第IIIA族,最外层有3个电子,其最外层电子排布式为4s24p1;故答案为:4s24p1;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的.Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,
这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,
根据能量最低原理先排4s电子后排3d电子,所以 最后排入的是3d电子,根据命名规则属d区,Fe为26号元素,原子核外电子数为26,则Fe的原子结构示意图 ,故答案为:d区;
,故答案为:d区; ;
;
(3)根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等.对于原子,原子序数=原子核外电子总数,所以,如果是分子,只要原子序数之和相等即可.CO中C是6号元素,O是8号元素,原子序数之和为14,N是7号元素,且可形成双原子分子,所以分子是N2.
故答案为:N2、CN-;
(4)根据元素周期表知,E是Cl元素,D是O元素,ED4-是ClO4-离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,价层电子对数=4+$\frac{1}{2}$(7+1-4×2)=4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型.
C、N、O、Cl是四种元素,两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO2 CCl4,故答案为:正四面体型;CO2 CCl4.
点评 本题考查基态原子或离子的核外电子排布或最外层电子排布、分子中原子采取的杂化方式、对于元素周期表,学习时要记住它的周期、族的划分,要熟记前36号元素,五区的划分、边界、划分依据等都要掌握,在学习中要灵活掌握根据VSEPR理论预测分子或离子的空间构型是学习的重点,也是近几年高考的热点.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
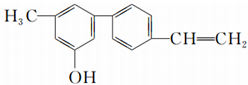
| A. | 该有机物属于烯烃 | B. | 该有机物属于醇 | ||
| C. | 该有机物分子中所有的原子都共面 | D. | 该有机物有两种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
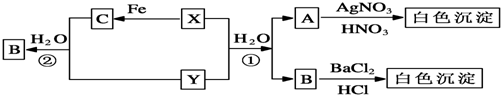
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
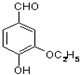 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.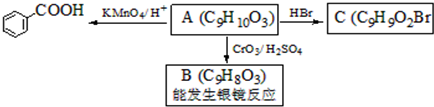
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.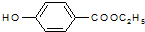 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用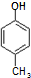 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).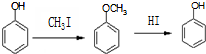
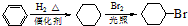
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | B、C、P元素的最高正化合价依次升高 | |
| C. | Si、P、S、C1原子半径依次增大 | |
| D. | Be、Mg、Ca、Ba的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯分子中的所有原子可能共平面 | |
| B. | 苯乙烯分子中的所有原子可能共平面 | |
| C. | 二氯甲烷分子为正四面体结构 | |
| D. | 丁烷分子中的所有碳原子不可能都在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液--------氧化铝 | B. | 次氯酸钠---------氯化钠 | ||
| C. | 碳酸氢镁--------碳酸镁 | D. | 硫酸铜--------氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁件上镀铜时,金属铜作阴极 | |
| B. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为CH3OH+6OH-+6e-═CO2+5H2O | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快 | |
| D. | 电解精炼铜时,电解质溶液中铜离子浓度保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com