
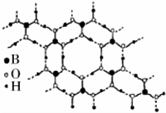
 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )| A. | H3BO3分子的稳定性与氢键有关 | |
| B. | 含1mol H3BO3的晶体中有3mol氢键 | |
| C. | 分子中B、O最外层为8e-稳定结构 | |
| D. | 同层分子间的主要作用力是范德华力 |
分析 A、稳定性是化学性质,取决于化学键的强弱,氢键只能影响熔沸点、密度等物理性质;
B、由结构可知,一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子;
C、由结构可知,硼原子最外层只有3个电子,与氧原子形成3对共用电子对;
D、H3BO3同层分子之间通过氢键相连.
解答 解:A、稳定性是化学性质,取决于化学键的强弱,氢键是属于分子间作用,与分子的稳定性无关,故A错误;
B、一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,故B正确;
C、硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构,故C错误;
D、层内的H3BO3分子之间主要通过氢键相连,故D错误;
故选B.
点评 本题考查晶体结构、氢键等,难度中等,主要考查学生阅读对题目信息与结构图获取知识的能力,注意正硼酸晶体层内存在H3BO3分子,以氢键结合,属于分子晶体.


科目:高中化学 来源: 题型:选择题
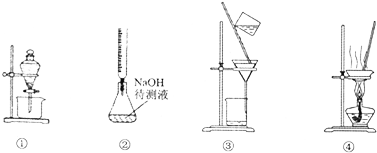
| A. | 图①表示分离CCl4和水的混合溶液的装置 | |
| B. | 图②表示已知浓度的盐酸溶液滴定未知浓度的氢氧化钠溶液的装置 | |
| C. | 图③表示分离二氧化锰和氯化锰溶液的装置 | |
| D. | 图④表示蒸干氯化铝溶液制AlCl3的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 | |
| B. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而加快油脂皂化反应速率 | |
| C. | 工业合成氨的反应属于能自发进行的反应,故能迅速发生 | |
| D. | 鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
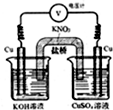 实验室利用如图所示装置.通过测电压求算Cu(OH)2的沉淀溶解平衡常数,工作一段时间后,两电极质量均增大.下列说法不正确的是( )
实验室利用如图所示装置.通过测电压求算Cu(OH)2的沉淀溶解平衡常数,工作一段时间后,两电极质量均增大.下列说法不正确的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的铜电极作正极 | ||
| C. | 总反应为Cu2+(aq)+2OH-(aq)?Cu(OH)2(s) | D. | 盐桥中的K+移向CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$

 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$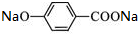 +
+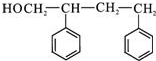 +H2O.
+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
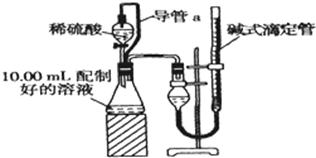 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
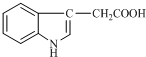 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )| A. | 吲哚乙酸与苯丙氨酸互为同分异构体 | |
| B. | 1 mol吲哚乙酸与足量氢气发生加成反应时,可以消耗5 mol H2 | |
| C. | 吲哚乙酸苯环上的二氯代物共有四种结构 | |
| D. | 吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com