
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | ||
| C. | HF、HCl、HBr | D. | CH4、C2H5OH、C4H10 |
分析 一般来说,晶体熔沸点高低顺序是原子晶体>离子晶体>分子晶体,金属晶体熔沸点差别较大,分子晶体熔沸点与其相对分子质量成正比,含有氢键的物质熔沸点较高,据此分析解答.
解答 解:A.O2为分子晶体,常温下为气体,熔点最低,I2常温下为固体,Hg常温下为液体,熔点由低到高顺序是O2、Hg、I2,故A错误;
B.二氧化碳是分子晶体、KCl是离子晶体、二氧化硅是原子晶体,所以熔点由低到高顺序是CO2、KCl、SiO2,故B正确;
C.只有HF中含有氢键,所以其熔沸点最高,这三种物质熔点由低到高顺序是HBr、HI、HF,故C错误;
D.这几种物质都是分子晶体,但乙醇中含有氢键,熔沸点最高,烷烃熔沸点与其相对分子质量成正比,所以这三种物质熔沸点由低到高顺序是CH4、C4H10、C2H5OH,故D错误;
故选B.
点评 本题考查晶体熔沸点高低顺序判断,明确晶体类型及晶体熔沸点高低规律即可解答,注意氢键对物质熔沸点的影响,易错选项是D.


科目:高中化学 来源: 题型:解答题
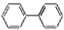 ,若分子中的两个氢原子被溴原子取代后有多种对称产物,如
,若分子中的两个氢原子被溴原子取代后有多种对称产物,如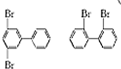
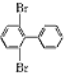 、
、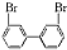 、
、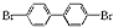 ;
;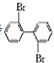 与
与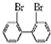 的相互关系是B.
的相互关系是B.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
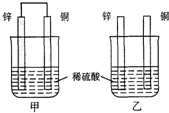 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂发生皂化反应能生成甘油 | |
| B. | 蛋白质溶液遇醋酸铅溶液发生盐析 | |
| C. | 氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应 | |
| D. | 乙二醇、甲醛、α-羟基丙酸(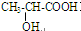 )都可发生缩聚反应 )都可发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇用于汽车防冻液 | |
| B. | 麦芽糖在水解前后均能发生银镜反应 | |
| C. | 1-氯丙烷和2-氯丙烷发生消去反应的产物不同 | |
| D. | H2N-CH2-COOH的缩聚产物中含  结构 结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2CO3 | C6H5ONa | 酸性:H2CO3>C6H5OH | |
| B | 液溴和苯 | 铁屑 | AgNO3溶液 | 液溴和苯发生取代反应 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐可以生成白色沉淀 | |
| D | 浓盐酸 | KMnO4 | FeBr2溶液 | 氧化性:Cl2>Br2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.| 金属离子 | Ksp | pH(10-1 mol•L-1) | pH(10-5 mol•L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜片、铅笔芯作电极插入稀硫酸中 | |
| B. | 用两个铜片作电极插入硝酸银溶液中 | |
| C. | 用锌片、铜片作电极插入番茄中 | |
| D. | 用铜片、铁片作电极插入酒精中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
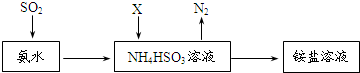
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com