
����Ŀ����֪��һ��̼ԭ����������ǻ�ʱ���ȶ���
������A����ͼ��ת����ϵ��
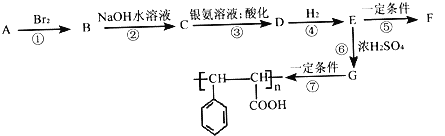
��1����֪1molA����2molBr2�ӳɣ�д��A�Ľṹ��ʽ___________________��д��B�ķ���ʽ___________________��
��2��D�к��������ŵ�����Ϊ______________��ָ����Ӧ�ķ�Ӧ���ͣ�___________________��
��3��д��C��������Һ��Ӧ�Ļ�ѧ����ʽ��_________________________________��
��4��E�ж���ͬ���칹�壬�������������Ĺ���__________�֡�
�����ڷ��㻯��� ����ʹFeCl3��Һ������ɫ��Ӧ��
�ۺ������Ľṹ�� �ܱ�����������ȡ������
���к˴Ź�����������6�����շ壬�����֮��Ϊ1��2��2��2��2��1���л���ṹ��ʽΪ___________________��
���𰸡� ![]() C9H8Br4 �Ȼ����ʻ� ��ȥ��Ӧ
C9H8Br4 �Ȼ����ʻ� ��ȥ��Ӧ 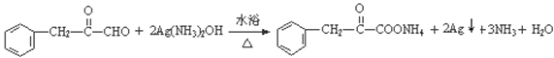 18
18 
����������������������ͼ֪������ͼ�д�A���߾��̼ԭ�Ӹ������䣬����A��̼ԭ�Ӹ���Ϊ9��A�Ƿ���������1molA����2molBr2�ӳɣ�˵�������к���1��̼̼����������A�в����Ͷ�Ϊ6���������ʽΪC9H8��A�����ӳɷ�Ӧ����B��B����ˮ�ⷴӦ����C��C���Է���������Ӧ��C�к���ȩ������A��̼̼����λ��ȡ�������ϣ�����A�Ľṹ��ʽΪ![]() ��B�ṹ��ʽΪ
��B�ṹ��ʽΪ![]() ��������֪��Ϣ��֪C�ṹ��ʽΪ
��������֪��Ϣ��֪C�ṹ��ʽΪ![]() ��C����������ӦȻ���ữ�õ�D��D�ṹ��ʽΪ
��C����������ӦȻ���ữ�õ�D��D�ṹ��ʽΪ![]() ��D�����ӳɷ�Ӧ����E��E�Ľṹ��ʽΪ
��D�����ӳɷ�Ӧ����E��E�Ľṹ��ʽΪ![]() �����ݢ�֪��G�����Ӿ۷�Ӧ���ɸ߾������G�ṹ��ʽΪ
�����ݢ�֪��G�����Ӿ۷�Ӧ���ɸ߾������G�ṹ��ʽΪ![]() ��E�������۷�Ӧ����F���ݴ˷������
��E�������۷�Ӧ����F���ݴ˷������
��⣺��1���������Ϸ�����֪A�Ľṹ��ʽΪ![]() ��B�ṹ��ʽΪ
��B�ṹ��ʽΪ![]() �����B�ķ���ʽΪC9H8Br4��
�����B�ķ���ʽΪC9H8Br4��
��2��D�ṹ��ʽΪ![]() ���京���������������Ȼ����ʻ���E������ȥ��Ӧ����G�����Ը÷�Ӧ����Ϊ��ȥ��Ӧ��
���京���������������Ȼ����ʻ���E������ȥ��Ӧ����G�����Ը÷�Ӧ����Ϊ��ȥ��Ӧ��
��3��C�ṹ��ʽΪ![]() ��C����������Ӧ����Ag����Ӧ����ʽΪ
��C����������Ӧ����Ag����Ӧ����ʽΪ![]() ��
��
��4��E�Ľṹ��ʽΪ![]() ��E��ͬ���칹��������������������ڷ��㻯����˵�����б���������ʹFeCl3��Һ������ɫ��Ӧ˵�����з��ǻ����ۺ������Ľṹ���ܱ�����������ȡ�������������-OH��-COOCH2CH3���ڼ�����ֽṹ���������-OH��-CH2COOCH3���ڼ�����ֽṹ���������-OH��-OOCCH2CH3���ڼ�����ֽṹ�������-OH��-CH2OOCCH3���ڼ�����ֽṹ�������-OH��-CH2CH2OOCH���ڼ�����ֽṹ�������-OH��-CH��CH3��OOCH���ڼ�����ֽṹ�����Է���������ͬ���칹����18�֣����к˴Ź�����������6�����շ壬˵����������ԭ�ӣ������֮��Ϊ1��2��2��2��2��1��˵��������ԭ�Ӹ���֮��Ϊ1��2��2��2��2��1��������������л���ṹ��ʽΪ
��E��ͬ���칹��������������������ڷ��㻯����˵�����б���������ʹFeCl3��Һ������ɫ��Ӧ˵�����з��ǻ����ۺ������Ľṹ���ܱ�����������ȡ�������������-OH��-COOCH2CH3���ڼ�����ֽṹ���������-OH��-CH2COOCH3���ڼ�����ֽṹ���������-OH��-OOCCH2CH3���ڼ�����ֽṹ�������-OH��-CH2OOCCH3���ڼ�����ֽṹ�������-OH��-CH2CH2OOCH���ڼ�����ֽṹ�������-OH��-CH��CH3��OOCH���ڼ�����ֽṹ�����Է���������ͬ���칹����18�֣����к˴Ź�����������6�����շ壬˵����������ԭ�ӣ������֮��Ϊ1��2��2��2��2��1��˵��������ԭ�Ӹ���֮��Ϊ1��2��2��2��2��1��������������л���ṹ��ʽΪ![]() ��
��


 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ���������������ֶ�����Ԫ�أ�����ĸx�ȱ�ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯����ͼ��ʾ��

�����жϳ���Ԫ�ػش����⣺
����Ԫ�ؿ������R��zx4f(gd4)2����ʢ��10mL 1mol��L��1R��Һ���ձ��еμ�1mol��L��1NaOH��Һ���������ʵ�����NaOH��Һ����ı仯ʾ��ͼ���£�

(1)R��Һ�У�����Ũ���ɴ�С��˳����___________________________________
(2)д��m�㷴Ӧ�����ӷ���ʽ��__________________________________________��
(3)����R��Һ�иļ�20mL 1.2mol��L��1 Ba(OH)2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ________ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������(FexO)1.52 g�������������У���������Һ��ͨ���״����112 mL Cl2��ǡ�ý�Fe2+��ȫ����������˵����ȷ����(����)
A. FexO�������������ֻ������FeCl3��H2O
B. ��״����112 mL Cl2�����ʵ�����5 mol
C. x=0.8
D. ͨ��Cl2������Ӧ�����ӷ���ʽ��Fe2++Cl2![]() Fe3++2Cl��
Fe3++2Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��10��5�գ��й�����ҩѧ�������ϻ��ŵ����������ѧ��ҽѧ�����������ǡ���Ϊ����������һһ����������ű����ҩ������ȫ���ر��Ƿ�չ�й��ҵ��������˵����������������Ǵ�ֲ��ƻ��ᆬҶ����ȡ�ģ���ṹ��ʽ����ͼ������˵������ȷ����
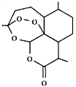
A. ���ķ���ʽΪC15H22O5
B. �÷�������6������̼ԭ��
C. ������й������ţ������ȶ�������ʪ���Ⱥͻ�ԭ�����ʵ�Ӱ�������
D. ���ڳ����л��ܼ��е��ܽ�ȴ�����ˮ�е��ܽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����;�ˮ���������(K2FeO4)Ϊ����ɫ���壬������ˮ�������Ի�������Һ���ֽ⣬�ڼ�����Һ���ȶ�����ҵ���Ʊ�K2FeO4�ij��÷��������֡�
������������������������������ͼ��ʾ��
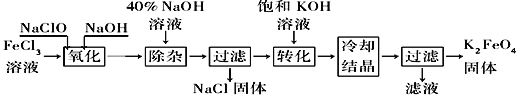
��1����ɡ������������з�Ӧ�Ļ�ѧ����ʽ��______FeCl3��______NaOH��______NaClO==______Na2FeO4��______![]() ��______
��______![]() ��____________������������________(�ѧʽ)��
��____________������������________(�ѧʽ)��
��2����ת���������з�����Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��3���������յõ��ĸ�����س��������ʣ������ؽᾧ���ᴿ�������ǽ��ֲ�Ʒ��________________�ܽ⣬Ȼ��________________��
������ⷨ������Ϊ�����������������Һ��Ȼ��������Һ�м���KOH��
��4�����ʱ����������Ӧ����FeO42�����õ缫��Ӧ����ʽΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʯ��ˮ�в���ͨ�������̼����Ĺ����У�����Һ�ĵ����Եı仯�ǣ��������ʾ�����ԣ��������ʾ������̼���壩
A. 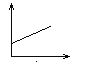 B.
B. 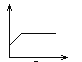 C.
C. 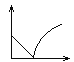 D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����ڱ��ж����ڵ�һ���֣�A��B��C����Ԫ�ص�ԭ�Ӻ��������֮�͵���B����������BԪ�ص�ԭ�Ӻ�������������������������������ȷ����( )

A. BΪ�ڶ����ڵ�Ԫ��
B. CΪVA��Ԫ��
C. ����Ԫ�ض�Ϊ�ǽ���Ԫ��
D. B�������л�ѧ��������õķǽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��CΪ��ѧ�������ʣ�����һ��Ϊ������ͨ�������AΪ���塢BΪ����ɫ���塢CΪ��ɫ���塣D��E��F��G��H��X��Ϊ���������X����������ɫ���壬��ˮ��Һ��һ������ǿ����Һ��EΪ��ɫ���壬H�ڳ�����ΪҺ�塣����֮���ת����ϵ��ͼ��ʾ������ijЩ��Ӧ�����Ͳ��ַ�Ӧ��������ȥ����
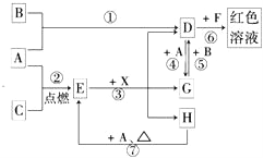
��1��д���������ʵĻ�ѧʽ��D___________��X_______________��
��2���ڷ�Ӧ�١����У�������������ԭ��Ӧ����_____________�����ţ���
��3����Ӧ�����ӷ���ʽΪ��______________________________________��
��4����G��Һ�м���NaOH��Һ�۲쵽��������________________________��
��5����Ӧ�ߵĻ�ѧ����ʽΪ____________________________________���÷�Ӧ��ÿ����0.3mol��A����ת�Ƶ���________mol��
��6����ȥD��Һ�л��е�����G�Ļ�ѧ����ʽ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.1mol/L��K2CO3��Һ����μ���0.1mol/L��ϡ����40mL����Һ�к�̼Ԫ�صĸ�����(CO2���ݳ�δ����)�����ʵ�����������ҺpH�仯���������ͼ��ʾ������˵����ȷ����
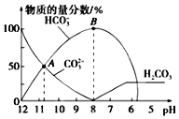
A. ����ϡ����ļ��룬��Һ��c(HCO3��)��c(OH��)/c(CO32��)���ֲ���
B. ����A����㣬Ka2(H2CO3)��������Ϊ10-3
C. B����������Һ�У�c(K+)+c(H+)=2c(CO32��)+c(HCO3��)+c(OH��)
D. ��pHԼΪ8ʱ����Һ�п�ʼ�ų�CO2����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com