
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCuO后恰好恢复到电解前的浓度,则电解过程中转移的电子数为 ( )
A.0.1 molB.0.2 molC.0.3 molD.0.4 mol
科目:高中化学 来源: 题型:
【题目】(14分)有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。
⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。
请写出:
(1)A元素的最高价氧化物的电子式 。
(2)B元素在周期表中的位置 。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有 。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的 。
(6)元素D与元素E相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填选项序号)。
a.常温下D的单质和E的单质状态不同
b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
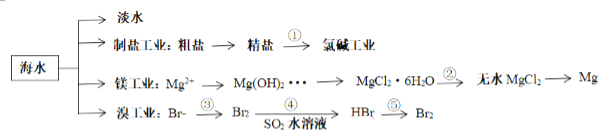
A. 海水制盐后可以利用氯碱工业,电解饱和食盐水制备金属钠
B. 在整个工艺制备过程中,未发生置换反应操作
C. 由 MgCl2·6H2O得到无水 MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)△H= - 92.4kJmol-1,在反应过程中,正反应速率的变化如图.下列说法不正确的是( )
2NH3(g)△H= - 92.4kJmol-1,在反应过程中,正反应速率的变化如图.下列说法不正确的是( )
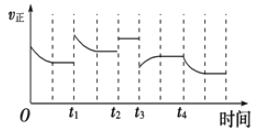
A. t1时增大了压强
B. t2时使用了催化剂
C. t3时降低了温度
D. t4时从体系中分离出部分氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.请回答下列问题:
(1)写出基态Cu2+的外围电子排布式:__________.C、N、O三种元素的第一电离能由小到大的顺序为__________(用元素符号表示).
(2)PO43-的空间构型是____________________________________________.
(3)氨基乙酸铜的分子结构如图,其中碳原子的杂化方式为______________.

(4)铁和铜是重要的金属,Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.六氰合亚铁离子[Fe(CN)6]4-中不存在___________________.
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(5)在硫酸铜溶液中加入过量氨水,生成配合物离子四氨合铜离子,请写出四氨合铜离子的结构式_________.
(6)NaCl晶胞中若r(Na+)=a pm,r(Cl-)=b pm,则NaCl晶胞的空间利用率为________.(晶胞中离子以密堆积方式存在,用含有a,b的列式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的资源。A~F是常见有机物,它们之间的转化关系如图1所示(部分产物和反应条件已略去),其中A的产量可以用来衡量一个国家的石油化工发展水平,E是最简单的芳香烃。回答下列问题:

(1)石油通过___________________可以得到A。
(2)步骤所用试剂X为___________(写化学式),D的官能团名称是___________;
(3)F的结构简式为_____________,步骤①的反应类型:____________;
(4)写出下列步骤中的化学方程式:
步骤③___________________________________;
步骤④___________________________________;
(5)用图所示实验装置制取乙酸乙酯。请回答:

试管b中所装溶液应为______,乙酸乙酯生成后,分离出产品时的操作方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制480 mL 3 mol· L—1的NaOH溶液,根据这种溶液的配制情况回答下列问题:
(1)配制上述溶液需要用烧杯、玻璃棒外,还需用到的玻璃仪器是__________(填仪器名称)。
(2)用托盘天平称量NaOH固体的质量为_________g,定容时的具体操作为____________________________________________________;
(3)若没有用少量水洗涤烧杯和玻璃棒2~3次,并将每次洗涤液转入容量瓶的操作,会使结果______(填偏高、偏低、无影响,下同),若定容时采用仰视刻度线,则所配制的溶液浓度将__________;
(4)取100 mL 3 mol· L—1的NaOH溶液,缓慢通入标况下6.72 L的CO2气体。反应的离子方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为_________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为_________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。
与CO互为等电子体的分子和离子分别为_________和_________(各举一种,填化学式);在CO分子中,键与π键数目之比为_________。
(3)铁与K2O、 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(4)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
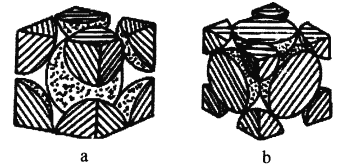
在图a所示堆积方式里铁原子的半径为rpm,则其晶胞棱长为_________cm。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为_________(用含圆周率π的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com