
| 1 |
| 2 |

| 1 |
| 2 |
| ||
| 10min |
| 3×0.4mol |
| 2.4mol |
| (0.4mol/L)2 |
| 0.6mol/L×(0.6mol/L)3 |
| 3 |
| ||
| 3 |
| ||
| 10-14 |
| 5×10-11 |


科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入溴水中 | 验证SO2具有漂白性 |
| B | 在滴有酚酞的Na2CO3溶液中, 加入BaCl2溶液后红色褪去 |
验证Na2CO3溶液中存在水解平衡 |
| C | 淀粉溶液和稀H2SO4混合加热,后加新制的Cu(OH)2悬浊液加热至沸腾 | 检验淀粉水解产物有还原性 |
| D | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中 | 检验气体中含有乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
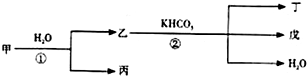 甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.
甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
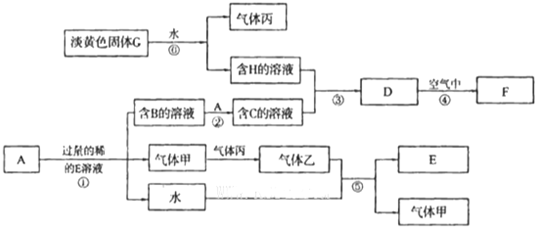
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气的体积为1.12L |
| B、原烧碱溶液中含溶质离子0.2NA |
| C、所得溶液中含OH-的数目为1×10-5NA |
| D、所得溶液中C1O-的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极发生的反应:2H++2e-=H2 |
| B、正极上的反应为:2Cl--2e-=Cl2 |
| C、阳极产生的气体能使湿润的淀粉-KI试纸变蓝 |
| D、电路中通过的电子数为6.02×1023时,共产生气体约11.2L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有 1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| B、脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| C、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D、脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com