
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
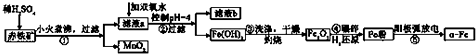
分析 Fe2O3、FeO、Al2O3、CuO与硫酸反应,a中金属阳离子为Cu2+、Al3+、Fe2+、Fe3+,加双氧水将Fe2+氧化为Fe3+.根据阳离子沉淀时pH数据,可知控制pH=4时,铁离子已全部变成Fe(OH)3沉淀,滤液b中主要为Cu2+、Al3+,氢氧化铁洗涤干燥灼烧得到氧化铁,碾碎用氢气还原得到金属铁粉,利用电弧加热使金属熔融蒸发成蒸汽,使大量颗粒状烟灰尘与周围不反应的气体原子激烈碰撞进行充分的能量交换和电荷交换生成α-Fe,
(1)步骤②滤液中含有的金属阳离子是Cu2+、Al3+; 步骤④中碾碎的目的是增大接触面积,提高原料的转化率和反应速率;
(2)MnO2与KClO3、KOH溶液共热,MnO2做还原剂,生成K2MnO4,KClO3做氧化剂生成KCl;
(3)灼烧固体需酒精灯、三脚架、泥三角、坩埚、坩埚钳;
(4)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,说明是生成了四氧化三铁.
解答 解:(1)步骤②滤液中含有的金属阳离子是Cu2+、Al3+; 步骤④中碾碎的目的是增大接触面积,提高原料的转化率和反应速率,
故答案为:Cu2+、Al3+; 增大接触面积,提高原料的转化率和反应速率;
(2)将第①步过滤所得的MnO2与KClO3、KOH溶液共热,可得到K2MnO4,MnO2做还原剂,生成K2MnO4,KClO3做氧化剂生成KCl,此反应的化学方程式是:
3MnO2+6KOH+KClO3=3 K2MnO4+KCl+3H2O,
故答案为:3MnO2+6KOH+KClO3=3 K2MnO4+KCl+3H2O;
(3)步骤③灼烧固体所需的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳,
故答案为:坩埚、坩埚钳;
(4)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,说明是生成了四氧化三铁,反应的化学方程式为:3Fe+2O2$\frac{\underline{\;撞击\;}}{\;}$Fe3O4,
故答案为:3Fe+2O2$\frac{\underline{\;撞击\;}}{\;}$Fe3O4.
点评 本题考查了物质分离、物质制备、实验基本操作、物质性质的理解应用等知识点,掌握基础是解题关键,题目难度中等


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
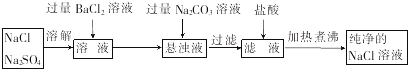
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
| 若无白色沉淀 | 滤液中无Ca(OH)2 | |
| 另取少量滤液,滴入适量盐酸 | 若出现气泡 | 滤液中含Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对右试管小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.
如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对右试管小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
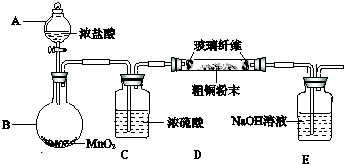
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 化学反应吸收或放出热量的多少与参加反应的物质的多少无关 | |
| D. | C(石墨,s)═C(金刚石,s)△H>0,所以石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
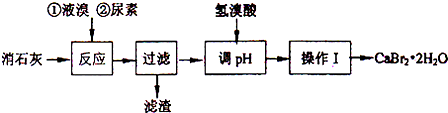
| 温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑦ | B. | ②⑤⑦ | C. | ①②⑤⑥⑦ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com