
【题目】列各组离子一定能在指定环境中大量共存的是( )
A.在c(H+)=10-10 mol/L的溶液中 Al3+ 、NH![]() 、Cl- 、NO
、Cl- 、NO![]()
B.pH值为13的溶液 K+ 、SO![]() 、Na+、S2-
、Na+、S2-
C.水电离出来的c(H+)=10-12mol/L的溶液 K+、NH4+、Cl-、ClO-
D.甲基橙呈红色的溶液中 Fe3+、Na+ 、SO42-、CO![]()
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.在硫化氢水溶液中加入碱有利于S2-的生成
B.加入催化剂有利于氨的氧化反应
C.高压有利于合成氨反应
D.向新制氯水中加入碳酸钙有利于次氯酸浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下装置处理含KMnO4的废液,使Mn元素转化为MnO2沉淀,从而消除重金属污染,下列说法错误的是

A. MnO4-处理完全后,实验结束时左侧可能会生成沉淀
B. 右侧产生的Fe2+沉淀MnO4-的离子方程式为:7H2O+3Fe2++MnO4-=3Fe(OH)3↓+MnO2↓+5H+
C. 当电路中转移6mole-时,可以产生87gMnO2沉淀
D. 为了增大右侧溶液的导电性可以加稀硫酸造成强酸性环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O![]() H3O++OH-
H3O++OH-
B.CO2+H2O![]() H2CO3
H2CO3
C.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
D.CO32-+ H2O![]() HCO3- +OH-
HCO3- +OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
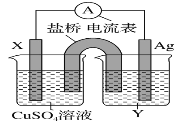
请回答下列问题:
(1)电极 X 的材料是__________填化学式);电解质溶液 Y 是______填化学式)。
(2)银电极发生______填“氧化”或“还原”)反应,其电极反应式为_________;X 电极反应式为_____。
II. 高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放 电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
请回答下列问题:
(1)已知放电时负极反应为 Zn-2e-+2OH- ===Zn(OH)2,则正极反应 为_____________。
(2)放电时,_____(填“正”或“负”)极附近溶液的 pH 升高。
(3)高铁电池充电时,电池的负极与电源的_____(填“正极”或“负极”),充 电时与电池负极相连的电极反应为__________。
III.近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和 水分子通过。其工作原理的示意图如下:
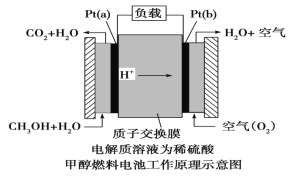
请回答下列问题: (1)该燃料电池的总反应为_________。
(2)Pt(a)电极是电池的_____(填“正”或“负”)极,电极反应式为:__________; Pt(b)电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生反应并达到平衡:3X(g) + Y(g)![]() 2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的2/3,则下列叙述正确的是
2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的2/3,则下列叙述正确的是
A. 若以X表示的反应速率为0.2 mol/(L·s),则以Z表示的反应速率为0.3 mol/(L·s)
B. 充入氦气增大容器内的压强,Y的转化率提高
C. 升高温度,平衡向正反应方向移动
D. 起始时刻n(X) : n(Y)= 2 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列变化的化学用语正确的是
A.氨水显碱性:NH3·H2O ![]() NH4++OH-
NH4++OH-
B.醋酸溶液显酸性:CH3COOH = CH3COO-+ H+
C.NaHCO3溶液显碱性:HCO3-+H2O ![]() CO32- + OH-
CO32- + OH-
D.FeCl3溶液显酸性:Fe3++3H2O = Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
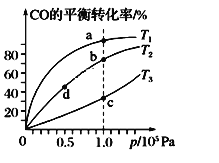
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c)、v(b)>v(d)
C.平衡常数:K(a)>K(c)、K(b)>K(d)
D.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,在1 L恒温恒容的密闭容器中,通入0.1molN2O4,发生反应:N2O4(g)![]() 2NO2(g)ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g)ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
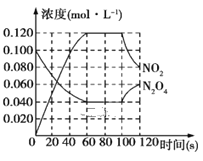
Ⅰ.(1)在0~60 s内,以N2O4表示的平均反应速率为____mol·L-1·s-1。
(2)反应进行到100s时,若只有一项条件发生变化,则变化的条件可能是____。
A.降低温度 B.通入氦气
C.又往容器中充入N2O4 D.增大容器容积
(3)已知: N2(g)+2O2(g)=2NO2(g) ΔH=+67.2kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1,N2O4(g)=2NO2(g) ΔH=+57.0kJ·mol-1,则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=____kJ·mol-1。
Ⅱ.向容积为2 L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。
H2(g)+CO2(g)。
(4)保持其他条件不变:
①若向平衡体系中再通入0.20molH2O(g),平衡将___(填“向右”、“向左”或“不”)移动,达到新的平衡状态后,H2O(g)的体积分数将____(“变大”、“变小”或“不变”);
②在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=____。(精确到小数点后两位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com