
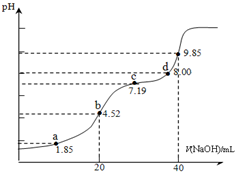
 已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)>3c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
分析 A.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液,a点溶液中溶质为H2SO3和NaHSO3,PH=1.85=Pa1,则c(H2SO3)=c(HSO3-)依据物料守恒判断;
B.b点是用0.1mol•L-1NaOH溶液20ml滴定20mL0.1mol•L-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,依据溶液中电荷守恒和物料守恒计算分析判断;
C.c点PH=7.19=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2O?HSO3-+OH-,Kh=$\frac{c(O{H}^{-})×c(HS{{O}_{3}}^{-})}{c(S{{O}_{3}}^{2-})}$=$\frac{Kw}{K{a}_{2}}$,c(OH-)=$\frac{Kw}{c({H}^{+})}$,c(HSO32-)=c(SO32-),结合溶液中物料守恒分析;
D.加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液恰好反应生成Na2SO3,d点溶液中主要是Na2SO3和少量NaHSO3.
解答 解:A.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液,a点溶液中溶质为H2SO3和NaHSO3,PH=1.85=Pa1,电离平衡常数表达式得到则c(H2SO3)=c(HSO3-),溶液体积大于20ml,a点所得溶液中:c(H2SO3)+c(SO32-)+c(HSO3-)=2c(H2SO3)+c(SO32-)<0.1 mol•L-1 ,故A错误;
B.b点是用0.1mol•L-1NaOH溶液20ml滴定20mL0.1mol•L-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),物料守恒c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),得到:c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B正确;
C.c点PH=7.19=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2O?HSO3-+OH-,Kh=$\frac{c(O{H}^{-})×c(HS{{O}_{3}}^{-})}{c(S{{O}_{3}}^{2-})}$=$\frac{Kw}{K{a}_{2}}$,c(OH-)=$\frac{Kw}{c({H}^{+})}$,c(HSO32-)=c(SO32-),带入计算得到:c(HSO32-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO32-),故C正确;
D.加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液恰好反应生成Na2SO3,d点溶液中主要是Na2SO3和少量NaHSO3,溶液中离子浓度c(Na+)>c(SO32-)>c(HSO3-),故D正确;
故选A.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷和甲醇 | B. | 丙醛和丙酮 | C. | 乙烯和乙炔 | D. | 乙烯和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在某弱酸HA溶液中加入NaA固体后,$\frac{c(HA)•c(O{H}^{-})}{c({A}^{-})}$减小 | |
| B. | 将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 常温下,0.1 mol•L-1的NH4HCO3溶液其pH=7.8,则Kb(NH3•H2O)>Ka1(H2CO3) | |
| D. | 已知常温低下Ksp(AgI)=2.0×10-16,在AgI悬浊液中加入少量KI粉末,AgI(s)?Ag+(aq)+I-(aq)平衡向左移动,溶液中离子的总浓度会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
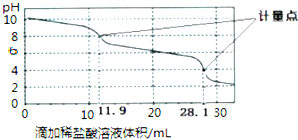
| A. | 此样品中NaHCO3的物质的量为(28.1-11.9)×10-4mol | |
| B. | 整个滴定过程中,溶液中阴离子总数始终不变 | |
| C. | 滴加稀盐酸的体积为11.90mL时:c(H+)+c(H2CO3)═c(OH-)+c(CO32-) | |
| D. | 该方法无法测定Na2CO3和NaOH混合溶液中NaOH的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该 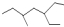 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 棉花、羊毛、合成纤维、油脂的成分都是高分子化合物 | |
| C. | 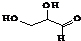 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,NH4Cl溶液加水稀释过程中,$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$数值增大 | |
| B. | O.lOOOmol•L-1 的醋酸钠溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1000mol•L-1 | |
| C. | 室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,则Ka1(H2CO3)×Ka2(H2CO3)<K | |
| D. | 室温,Ka(CH3COOH)=l.76×l0-5,Kb(NH3•H2O)=1.76×lO-5.则CH3COONH4溶液中存在:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-)>c(NH3•H2O)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 操作 | 现象 |
| 向该绿色溶液中通入氮气(或向硝酸铜溶液中通入浓硝酸与铜反应产生的气体) | 溶液颜色变蓝(或绿色加深) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g H218O与2H2O的混合物中所含中子数约为6.02×1023 | |
| B. | 2Mg(s)+CO2(g)=C(s)+2MgO(s)在一定条件下能自发进行,说明该反应的△H<0 | |
| C. | 向硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,向沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清,说明苯酚的酸性强于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com