
��һ���¶��£����ݻ�Ϊ2 L�������ڣ�ij��Ӧ������(��Ϊ����)�����ʵ����淴Ӧʱ��ı仯������ͼ���Իش��������⣺

(1)��t1��5 S����ǰ5S��M��ʾ�ķ�Ӧ����Ϊ________��
(2)t2ʱ������Ӧ����________(����ڡ������ڡ���С�ڡ�)�淴Ӧ���ʣ�
(3)����˵����ȷ����________��
A��t2ʱ�̸÷�Ӧ�ﵽƽ��
B��t3ʱ�̸÷�Ӧ�ﵽƽ��
C����Ӧ��ʼʱ���������Ũ��Ϊ0
D���÷�Ӧ�����ǿ��Ըı��
 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
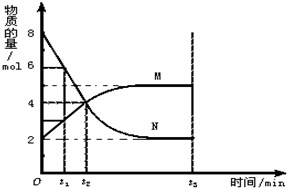 ��һ���¶��£����ݻ�Ϊ2L�������ڣ�ij��Ӧ�����ʣ���Ϊ���壩�����ʵ����淴Ӧʱ��ı仯������ͼ���Իش��������⣺
��һ���¶��£����ݻ�Ϊ2L�������ڣ�ij��Ӧ�����ʣ���Ϊ���壩�����ʵ����淴Ӧʱ��ı仯������ͼ���Իش��������⣺ M
M M
M�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 Ŀǰ��ȫ���������Ϊ�����������������������������������Ҫԭ��֮һ���������������ж��ַ������������ϰ�װ��Ч��ת��������ʹ����β���е���Ҫ��Ⱦ�CO��NOx��̼�⻯����������Ӧ�����������ʣ���������β����Ⱦ��
Ŀǰ��ȫ���������Ϊ�����������������������������������Ҫԭ��֮һ���������������ж��ַ������������ϰ�װ��Ч��ת��������ʹ����β���е���Ҫ��Ⱦ�CO��NOx��̼�⻯����������Ӧ�����������ʣ���������β����Ⱦ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��16.7% | B��50% | C��66.7% | D��83.3% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(6��)��һ���¶��£����ݻ�Ϊ2L�������ڣ�ij��Ӧ�����ʣ���Ϊ���壩�����ʵ����淴Ӧʱ��ı仯������ͼ���Իش��������⣺
��1����t1��5S����ǰ5S��M��ʾ�ķ�Ӧ����Ϊ������������������������
��2��t2ʱ������Ӧ������������������ڡ������ڡ���С�ڡ����淴Ӧ���ʡ�
��3������˵����ȷ���ǣ� ��
A�� t2ʱ�̸÷�Ӧ�ﵽƽ��
B�� t3ʱ�̸÷�Ӧ�ﵽƽ��
C����Ӧ��ʼʱ���������Ũ��Ϊ0
D���÷�Ӧ�����ǿ��Ըı��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ӱ�ʡ�߶���ѧѡ���������Ծ��������棩 ���ͣ������
�ס��������������ݻ��̶����ҵ��ݻ��ɱ䡣��һ���¶��£������ͨ��3mol N2��4mol H2����Ӧ�ﵽƽ��ʱ������NH3�����ʵ���Ϊamol��
��1����ͬ�¶��£�������ͨ��2molNH3���ұ����ݻ������ͬ������Ӧ�ﵽƽ��ʱ�������ʵ�Ũ�����ƽ������ͬ����ʼʱ���л�ͨ����____mol N2��____mol H2��
��2����ͬ�¶��£���������ͨ��6mol N2��8mol H2���ұ���ѹǿ�����ȣ�����Ӧ�ﵽƽ��ʱ�����ɰ������ʵ���Ϊb mol����a��b______1��2����������ݻ�ʼ����ȣ��ﵽƽ��ʱ�����ɰ������ʵ���Ϊc mol����a��c_____1��2 (�����������������)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com