
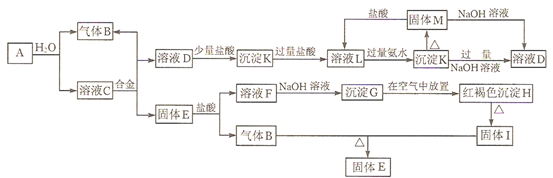
分析 沉淀D在空气中转化红褐色沉淀H,G→H的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,则G为Fe(OH)2,H为Fe(OH)3,H加热分解得到I为Fe2O3,框图中的“合金”由两种金属组成,由转化关系,根据元素守恒可知,合金中含有Fe,C溶液进行焰色反应,则火焰呈黄色,则C含有Na元素,而A与水反应得到C与气体B,故C为NaOH,合金与C溶液反应而分离得到固体E与D溶液,则合金含有Al,可推知E为Fe,F为FeCl2,B为H2,则A为Na,结合转化关系,可知D为NaAlO2,K为Al(OH)3,L为AlCl3,M为Al2O3,据此解答.
解答 解:沉淀D在空气中转化红褐色沉淀H,G→H的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,则G为Fe(OH)2,H为Fe(OH)3,H加热分解得到I为Fe2O3,框图中的“合金”由两种金属组成,由转化关系,根据元素守恒可知,合金中含有Fe,C溶液进行焰色反应,则火焰呈黄色,则C含有Na元素,而A与水反应得到C与气体B,故C为NaOH,合金与C溶液反应而分离得到固体E与D溶液,则合金含有Al,可推知E为Fe,F为FeCl2,B为H2,则A为Na,结合转化关系,可知D为NaAlO2,K为Al(OH)3,L为AlCl3,M为Al2O3,
(1)由上述分析可知,A为Na,M为Al2O3,H为Fe(OH)3,
故答案为:Na;Al2O3;Fe(OH)3;
(2)G→H的反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,现象为:白色沉淀迅速变为灰绿色,最终变为红褐色,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;白色沉淀迅速变为灰绿色,最终变为红褐色;
(3)A+水→B+C是钠与水的反应生成氢氧化钠与氢气,离子反应为:2Na+2H2O=2Na++2OH-+H2↑,
K→D为氢氧化铝与碱反应生成偏铝酸钠的反应,离子反应为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查无机物的推断,涉及Al、Fe元素化合物的性质与转化,根据物质的颜色、焰色反应结合转化关系推断需要学生熟练掌握元素化合物性质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{3a}{2B}$mol/L | B. | $\frac{a}{27B}$mol/L | C. | $\frac{a}{18B}$mol/L | D. | $\frac{2a}{81B}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
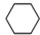 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$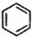 (g)+3H2(g)△H>0,若该反应在恒容的密闭容器中进行,下列有关该反应的图象判断正确的是( )
(g)+3H2(g)△H>0,若该反应在恒容的密闭容器中进行,下列有关该反应的图象判断正确的是( )| A. |  | B. | 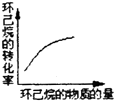 | C. | 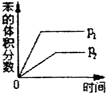 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
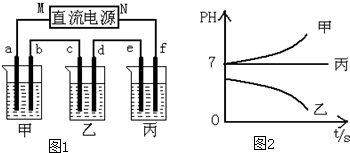
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol某气体的体积为22.4L,该气体的状况不一定是标准状况 | |
| B. | 1 mol H2O中含有的质子数为9NA | |
| C. | 2.4g镁由原子变为离子时,失电子为0.1NA | |
| D. | 将1mol CO2气体变成固体,其所含的分子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
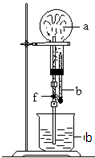 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )| a(干燥气体) | b(液体) | |
| ① | N02 | 水 |
| ② | CO2 | 4mol•L-1NaOH溶液 |
| ③ | C12 | 饱和食盐水 |
| ④ | NH3 | l mol•L-1盐酸 |
| A. | ①和② | B. | ③和④ | C. | ①和③ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的化学反应都有能量变化 | |
| B. | 只要有能量的变化,一定发生了化学反应 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
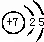 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Q1+0.5Q2 | B. | 4Q1+Q2+10Q3 | C. | 4Q1+2Q2 | D. | 4Q1+0.5Q2+9Q3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com