
| A. | $\frac{3a}{2B}$mol/L | B. | $\frac{a}{27B}$mol/L | C. | $\frac{a}{18B}$mol/L | D. | $\frac{2a}{81B}$mol/L |
分析 由n=$\frac{m}{M}$计算Al3+的物质的量,由化学式中离子的关系确定SO42-的物质的量,然后利用c=$\frac{n}{V}$来计算SO42-的物质的量浓度.
解答 解:Al3+的物质的量为$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol,
由硫酸铝的化学式Al2(SO4)3,则SO42-的物质的量为$\frac{a}{27}$mol×$\frac{3}{2}$=$\frac{a}{18}$mol,
则溶液中SO42-的物质的量浓度为$\frac{\frac{a}{18}mol}{BL}$=$\frac{a}{18B}$mol•L-1,
故选C.
点评 本题考查物质的量浓度的计算,难度不大,注意根据化学式判断离子物质的量关系.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42ˉ=BaSO4↓ | |
| C. | 氯化铝溶液与过量氨水反应:Al3++3OH-=Al(OH)3↓ | |
| D. | 常温下,用氢氧化钠溶液吸收多余的氯气:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| B. | pH相等的①CH3COONa、②C6H5ONa、③Na2CO3、④NaOH四种溶液的物质的量浓度大小:①>②>③>④ | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 向0.1 mol•L-1 NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
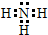 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系.
A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系. 、D
、D .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>R>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:R>Z>W | |
| C. | 对应单质的沸点:X>Z>Y | |
| D. | RY2、WY2通入BaCl2溶液中均无白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸呈红色的溶液中可能大量存在以下离子:Na+、NH4+、I-、NO3- | |
| B. | 将CH3COOH溶液和NaOH溶液等体积混合,该溶液中一定存在的关系式为:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3的NaHA溶液中粒子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) | |
| D. | CuSO4溶液遇到闪锌矿(ZnS)慢慢转化为铜蓝(CuS),是因为ZnS的溶解度大于CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
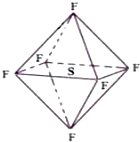 六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )
六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )| A. | 六氟化硫易燃烧生成二氧化硫 | |
| B. | 六氟化硫中各原子均达到8电子稳定结构 | |
| C. | 六氟化硫分子中的S-F键都是σ键,且键长、键能都相等 | |
| D. | 六氟化硫分子是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
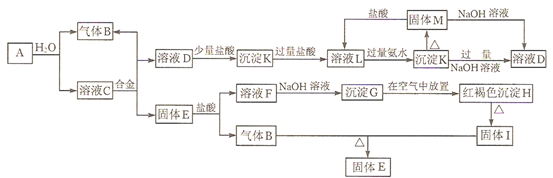
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com